题目内容
14.下列说法不符合ⅦA族元素性质特征的是( )| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
分析 ⅦA族元素原子最外层有7个电子,发生化学反应时容易得到1个电子而达到稳定结构,根据元素周期律的递变规律可知,同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,最高价氧化物对应的水化物酸性逐渐减弱,从上到下原子半径逐渐增大.
解答 解:A、氟无正价,故A错误;
B.同主族元素从上到下原子核外电子层数逐渐增多,则半径逐渐增大,故B错误;
C.同主族元素从上到下元素的非金属性逐渐减弱,得电子能力减小,故C正确;
D.同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,故D正确.
故选AB.
点评 本题考查同主族元素的递变规律,题目难度不大,注意把握元素周期律的递变.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
7.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | v正(X)=v逆(Z) | |
| C. | 容器内X、Y、Z的浓度之比为l:2:2 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
2.下列说法正确的是( )
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: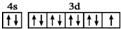 | |
| D. | 基态碳原子的最外层电子排布图: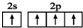 |
9.一定温度下,向 a L密闭容器中加入1mol X 气体和2mol Y 气体,发生如下反应:X(g)+2Y(g)?3Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不再随时间变化 | |
| B. | 单位时间内消耗0.1 mol X 的同时生成0.3 molZ | |
| C. | 容器内XYZ的浓度比为1:2:3 | |
| D. | 容器内各物质浓度不再随时间变化 |
19.下列物质性质的变化规律与分子间作用力有关的是( )
| A. | HF、HCl、HBr、HI热稳定性依次减弱 | |
| B. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| C. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
6.下列实验操作叙述正确的是( )
| A. | 实验用剩的药品应放回原试剂瓶中 | |
| B. | 切割白磷时应该在水下进行 | |
| C. | 测某酸性溶液的pH时,先用水将pH试纸湿润 | |
| D. | 在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干 |
3.下列关于键的说法正确的是( )
| A. | 只含共价键的物质一定是共价化合物 | |
| B. | HF、HCl、HBr、HI沸点逐渐增加是因为分子量逐渐增加 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 金属与非金属之间形成的是离子键,非金属之间则形成的是共价键 |
