题目内容
14.某烃折合为标准状况下的密度为3.215g/L,现取3.6g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重11g,求:(1)该烃的相对分子质量
(2)确定该烃的分子式.
分析 (1)摩尔质量=密度×气体摩尔体积,摩尔质量以g/mol作单位,数值上等于其相对分子质量;
(2)浓硫酸增重5.4g为生成的水的质量,碱石灰增重11g为燃烧生成CO2的质量,根据C原子、H原子守恒可计算出3.6g烃中C原子、H原子的物质的量,据此计算烃中C原子、H原子的个数比,即求出的实验式,再结合烃的相对分子质量确定其分子式.
解答 解:(1)烃的摩尔质量为:3.215g/L×22.4L/mol=72g/mol,摩尔质量以g/mol作单位,数值上等于其相对分子质量,所以该烃的相对分子质量为72,
答:该烃的相对分子质量为72;
(2)生成水的物质的量为:n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,则:n(H)=2n(H2O)=0.3mol×2=0.6mol,
生成CO2的物质的量为:n(CO2)=$\frac{11g}{44g/mol}$=0.25mol,则:n(C)=n(CO2)=0.25mol,
烃中C原子、H原子的个数比为0.25mol:0.6mol=5:12,实验式为C5H12,
该实验式中C原子与H原子的关系满足烷烃关系,实验式即是分子式,所以该烃的分子式为C5H12,
答:该烃的分子式为C5H12.
点评 本题考查有机物分子式的确定,题目难度中等,注意掌握常见的有机物分子式的确定方法,明确根据质量守恒定律确定有机物的分子式的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.利用电解法可将Fe、Zn、Ag、Au等杂质的粗铜提纯,下列叙述正确的是( )
| A. | 电解时以纯铜作阳极 | |
| B. | 电解时阳极发生还原反应 | |
| C. | 纯铜连接电源负极,电极反应是Cu-2e-=Cu2+ | |
| D. | 电解后,电解槽底部会形成含少量Ag、Au等金属阳极泥 |
5.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | HCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.做化学实验时,必须十分重视安全和环保问题.下列操作方法不符合上述要求的是( )
| A. | 制取氧气时,用排水法收集氧气出现倒吸现象,立即打开试管上的橡皮塞 | |
| B. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |
19.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18gNH4+中含有的电子数为11NA | |
| B. | 12g石墨中含有的共价键数为1.5NA | |
| C. | 标准状况下,22.4LNO2和CO2混合物中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成 Na2O和Na2O2的混合物,钠失去NA个电子 |
2.下列说法正确的是( )
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: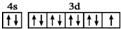 | |
| D. | 基态碳原子的最外层电子排布图: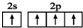 |