题目内容
19.在标准状况下盛满HCl气体的烧瓶,将烧瓶倒置于水中,使水充满烧瓶,如果氯化氢均溶解在烧瓶中(假设HCl无损失),所得盐酸的物质的量浓度为( )| A. | 1mol/L | B. | 0.5mol/L | C. | 0.045mol/L | D. | 0.45mol/L |
分析 溶液体积等于HCl的体积,设HCl的体积为VL,利用n=$\frac{V}{Vm}$计算HCl物质的量,再根据c=$\frac{n}{V}$计算所得溶液物质的量浓度.
解答 解:设HCl的体积为VL,标准状况下,n(HCl)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
液体最终充满整个试管,假定溶质不扩散,溶液的体积为VL,则c=$\frac{\frac{V}{22.4}mol}{VL}$=0.045mol/L,
故选C.
点评 本题考查物质的量浓度的计算,明确气体体积、溶液体积的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
10.进行下列反应后,所得溶液中一定只含有一种溶质的是( )
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入Na2CO3溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 将CO2通入一定量的NaOH溶液中 |
7.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | v正(X)=v逆(Z) | |
| C. | 容器内X、Y、Z的浓度之比为l:2:2 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
14.下列说法正确的是( )
| A. | 一氯代物只有一种的烷烃只能是甲烷 | |
| B. | 二氯甲烷无同分异构体,说明甲烷分子是正四面体结构 | |
| C. | 组成上相差一个或多个CH2的有机物一定互为同系物 | |
| D. | 能使酸性高能酸钾溶液褪色的烃一定含有C=C或C≡C |
2.下列说法正确的是( )
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: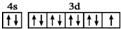 | |
| D. | 基态碳原子的最外层电子排布图: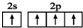 |
9.一定温度下,向 a L密闭容器中加入1mol X 气体和2mol Y 气体,发生如下反应:X(g)+2Y(g)?3Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不再随时间变化 | |
| B. | 单位时间内消耗0.1 mol X 的同时生成0.3 molZ | |
| C. | 容器内XYZ的浓度比为1:2:3 | |
| D. | 容器内各物质浓度不再随时间变化 |
6.下列实验操作叙述正确的是( )
| A. | 实验用剩的药品应放回原试剂瓶中 | |
| B. | 切割白磷时应该在水下进行 | |
| C. | 测某酸性溶液的pH时,先用水将pH试纸湿润 | |
| D. | 在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干 |
7.有一种阳离子与两种酸根离子组成的盐,称为混盐.混盐CaOCl2在酸性条件下,可产生Cl2.则下列有关混盐CaOCl2的判断正确的是( )
| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |