题目内容
15.将30mL0.5mol/L NaOH 溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量为( )| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
分析 根据稀释定律,稀释前后溶质NaOH的物质的量不变,据此计算稀释后NaOH溶液的物质的量.
解答 解:令稀释后NaOH溶液的物质的量浓度为c,根据稀释定律,稀释前后溶质NaOH的物质的量不变,则稀释后溶液中NaOH的物质的量为0.03L×0.5mol/L=0.015mol,
故选C.
点评 本题考查了物质的量浓度的有关计算,侧重于稀释定律的应用的考查,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
5.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | HCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
10.进行下列反应后,所得溶液中一定只含有一种溶质的是( )
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入Na2CO3溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 将CO2通入一定量的NaOH溶液中 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.8 g 重水(D2O)中含有的中子数为NA | |
| B. | 常温常压下,22.4 L O2 含有的分子数为NA | |
| C. | 1 L 1 mol/L FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 0.1 mol CO2分子中含有的共用电子对的数目是0.4 NA |
7.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | v正(X)=v逆(Z) | |
| C. | 容器内X、Y、Z的浓度之比为l:2:2 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
2.下列说法正确的是( )
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: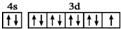 | |
| D. | 基态碳原子的最外层电子排布图: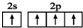 |
3.下列关于键的说法正确的是( )
| A. | 只含共价键的物质一定是共价化合物 | |
| B. | HF、HCl、HBr、HI沸点逐渐增加是因为分子量逐渐增加 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 金属与非金属之间形成的是离子键,非金属之间则形成的是共价键 |