题目内容
A、B、C、D、E 4种元素的原子序数均小于20,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.E 与 C 同主族,且原子半径比C小.
(1)E原子结构示意图 ;B在周期表中的位置第 周期,第 族;
(2)B、E形成的气态氢化物的稳定性(用化学式表示) ;
(3)比较C的阴离子与D的阳离子的离子半径大小(用离子符号表示) ;
(4)写出A、C、D、E 四种元素形成的一种盐的名称 .
(1)E原子结构示意图
(2)B、E形成的气态氢化物的稳定性(用化学式表示)
(3)比较C的阴离子与D的阳离子的离子半径大小(用离子符号表示)
(4)写出A、C、D、E 四种元素形成的一种盐的名称
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E 4种元素的原子序数均小于20,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,应处于第二周期,其最高价氧化物对应水化物的化学式为HBO3,最高正化合价为+5,则B为N元素;C元素原子的最外层电子数比次外层少2个,原子只能有3个电子层,最外层电子数为8-2=6,则C为S元素;E与C同主族,且原子半径比C小,则E为O元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为18,两元素可形成化合物D2C,该化合物中D为+1价,故D为K元素,据此计算.
解答:
解:A、B、C、D、E 4种元素的原子序数均小于20,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,应处于第二周期,其最高价氧化物对应水化物的化学式为HBO3,最高正化合价为+5,则B为N元素;C元素原子的最外层电子数比次外层少2个,原子只能有3个电子层,最外层电子数为8-2=6,则C为S元素;E与C同主族,且原子半径比C小,则E为O元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为18,两元素可形成化合物D2C,该化合物中D为+1价,故D为K元素,
(1)E为O元素,原子结构示意图为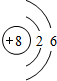 ;B为N元素,在周期表中的位置为第二周期第ⅤA族,
;B为N元素,在周期表中的位置为第二周期第ⅤA族,
故答案为: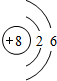 ;二、ⅤA;
;二、ⅤA;
(2)非金属性N<O,故形成的气态氢化物的稳定性H2O>NH3,故答案为:H2O>NH3;
(3)S2-、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->K+,故答案为:S2->K+;
(4)H、S、K、O 四种元素形成的一种盐有:硫酸氢钾、亚硫酸氢钾等,故答案为:硫酸氢钾或亚硫酸氢钾等.
(1)E为O元素,原子结构示意图为
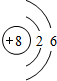 ;B为N元素,在周期表中的位置为第二周期第ⅤA族,
;B为N元素,在周期表中的位置为第二周期第ⅤA族,故答案为:
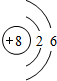 ;二、ⅤA;
;二、ⅤA;(2)非金属性N<O,故形成的气态氢化物的稳定性H2O>NH3,故答案为:H2O>NH3;
(3)S2-、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->K+,故答案为:S2->K+;
(4)H、S、K、O 四种元素形成的一种盐有:硫酸氢钾、亚硫酸氢钾等,故答案为:硫酸氢钾或亚硫酸氢钾等.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意掌握氢化物稳定性、微粒半径比较.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列性质比较中,正确的是( )
| A、热稳定性:CH4>SiH4 |
| B、酸性:H2SO4>HClO4 |
| C、熔点、沸点:O2>S |
| D、原子半径:N>P |
下表所示的是某些弱酸的电离常数(常温下),下列判断或说法不正确的是( )
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | K1=4.4x 10-7 K2=4.7x 10-11 |
CH3COOH | K=1.75x 10-5 |
| H2SO3 | K1=1.54x 10-2 K2=1.01x 10-7 |
H2C2O4 | K1=5.4x 10-2 K2=5.4x 10-5 |
| A、上述四种酸的酸性强弱顺序为:H2C2O4>H2SO3>CH3COOH>H2CO3 |
| B、物质的量浓度相等的CH3COONa、NaHCO3两溶液中:c(CH3COO-)>c(HCO3-) |
| C、0.1mol/L NaHSO3溶液中的电荷守恒表达式:c(Na+)+c(H+)=c(HSO3-)+2 c(SO32-)+c(OH-) |
| D、0.1mol/L NaHC2O4溶液中c(Na+)、c(HC2O4-)、c(OH-)、c(H+)的大小顺序为:c(Na+)>c(HC2O4-)>c(OH-)>c(H+) |
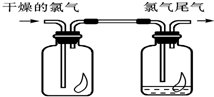 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
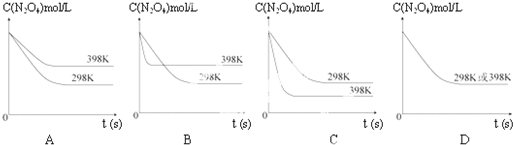
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是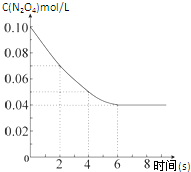 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).