题目内容
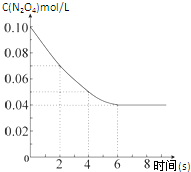 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).(1)计算在2s至4s时间内,NO2的平均生成速率为
(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,二氧化氮的起始浓度是
(3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于
(4)若在7s时向该密闭容器中再充入0.10mol N2O4气体,此时平衡向
A.α2<α1 B.α2>α1 C.α2=α1 D.无法判断.
(5)下表是不同温度下测定的该反应的化学平衡常数.
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
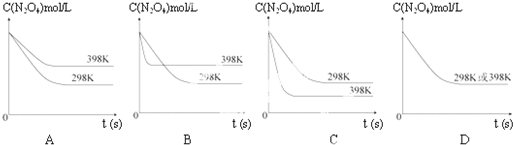
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)根据v=
计算反应速率;
(2)根据等效平衡的思想可以判断;
(3)根据三段式可以计算转化率和平衡常数;
(4)根据浓度和压强对平衡的影响可以作判断;
(5)根据温度对平衡的影响可以判断;
(6)根据温度对平衡移动的影响可以判断.
| △c |
| △t |
(2)根据等效平衡的思想可以判断;
(3)根据三段式可以计算转化率和平衡常数;
(4)根据浓度和压强对平衡的影响可以作判断;
(5)根据温度对平衡的影响可以判断;
(6)根据温度对平衡移动的影响可以判断.
解答:
解:(1)在2s至4s时间内,NO2的平均生成速率v=
=
=0.02mol?L-1?S-1,故答案为:0.02mol?L-1?S-1;
(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,即与原平衡为等效平衡,根据等效平衡的特点,充入的二氧化氮气体折算成四氧化二氮,与原浓度一样,所以折算为二氧化氮作为起始物时,其浓度0.20mol?L-1,故答案为:0.20;
(3)利用三段式
N2O4 2NO2
2NO2
起始浓度(mol?L-1) 0.1 0
转化浓度(mol?L-1) 0.06 0.12
平衡浓度(mol?L-1) 0.04 0.12
∴四氧化二氮的转化率α1=
×100%=60%,
化学平衡常数为
=0.36mol?L-1
故答案为:60%;0.36;
(4)根据平衡移动原理,增加反应物浓度平衡正向移动;在容积不变的条件下,再充入0.10mol N2O4气体,达到平衡时体系的压强比原平衡体系压强大,N2O4的转化率下降工,故α2<α1,故答案为:正;A;
(5)由图表可知温度升高K值增大,平衡正向移动,所以正反应为吸热反应,故答案为:吸;
(6)若其他条件不变,反应在398K条件下进行并达到平衡,与原平衡相比,平衡正向移动,N2O4气体的浓度下降,故C图符合要求,故答案为:C.
| △c |
| △t |
| (0.07mol?L-1-0.05mol?L-1)×2 |
| 2s |
(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,即与原平衡为等效平衡,根据等效平衡的特点,充入的二氧化氮气体折算成四氧化二氮,与原浓度一样,所以折算为二氧化氮作为起始物时,其浓度0.20mol?L-1,故答案为:0.20;
(3)利用三段式
N2O4
 2NO2
2NO2起始浓度(mol?L-1) 0.1 0
转化浓度(mol?L-1) 0.06 0.12
平衡浓度(mol?L-1) 0.04 0.12
∴四氧化二氮的转化率α1=
| 0.06mol?L-1 |
| 0.1mol?L-1 |
化学平衡常数为
| (0.12mol?L-1)2 |
| 0.04mol?L-1 |
故答案为:60%;0.36;
(4)根据平衡移动原理,增加反应物浓度平衡正向移动;在容积不变的条件下,再充入0.10mol N2O4气体,达到平衡时体系的压强比原平衡体系压强大,N2O4的转化率下降工,故α2<α1,故答案为:正;A;
(5)由图表可知温度升高K值增大,平衡正向移动,所以正反应为吸热反应,故答案为:吸;
(6)若其他条件不变,反应在398K条件下进行并达到平衡,与原平衡相比,平衡正向移动,N2O4气体的浓度下降,故C图符合要求,故答案为:C.
点评:本题考查了化学平衡图象、转化率计算、平衡常数的计算、等效平衡的思想等知识,中等难度,在解题时要注意准确运用图表中信息解答相关问题.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
有关烷烃的叙述:①都是易燃物②特征反应是取代反应③碳原子数相邻的两个烷烃分子在组成上相差一个“-CH3”,其中正确的是( )
| A、①② | B、①③ | C、① | D、②③ |
