题目内容
5.下列关于有机化合物的认识不正确的是( )| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
分析 A.油脂含C、H、O元素;
B.蔗糖、麦芽糖的分子式都是C12H22O11,均为二糖,结构不同;
C.油中含碳碳双键;
D.苯与浓硝酸共热生成硝基苯,苯中H被硝基取代.
解答 解:A.油脂含C、H、O元素,在空气中完全燃烧转化为水和二氧化碳,故A正确;
B.蔗糖、麦芽糖的分子式都是C12H22O11,均为二糖,结构不同,二者互为同分异构体,故B正确;
C.油中含碳碳双键,能使高锰酸钾褪色,而苯和脂肪不能,故C错误;
D.苯与浓硝酸共热生成硝基苯,苯中H被硝基取代,为取代反应,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物的组成、性质及反应,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列排列顺序正确的是( )
①原子半径:Na>Al>N ②热稳定性:H2O>HF>H2S
③还原性:S2->Cl->F- ④酸性:H3PO4>H2SO4>HClO4.
①原子半径:Na>Al>N ②热稳定性:H2O>HF>H2S
③还原性:S2->Cl->F- ④酸性:H3PO4>H2SO4>HClO4.
| A. | ②④ | B. | ①③ | C. | ①④ | D. | ②③ |
17.下列物质性质与应用对应关系正确的是( )
| A. | 福尔马林具有防腐性,可用于制备酚醛树脂 | |
| B. | 甘油具有吸水性,可用作抗冻剂 | |
| C. | 乙酸乙酯能水解,可用于制备肥皂 | |
| D. | 淀粉水解能生成葡萄糖,可用于制备乙醇 |
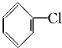 制取
制取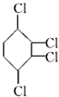 ,其合成流程如下:
,其合成流程如下:
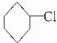 .
. ,
,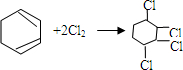 .
.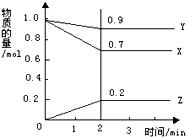 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min). 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: