题目内容
16.下列排列顺序正确的是( )①原子半径:Na>Al>N ②热稳定性:H2O>HF>H2S
③还原性:S2->Cl->F- ④酸性:H3PO4>H2SO4>HClO4.
| A. | ②④ | B. | ①③ | C. | ①④ | D. | ②③ |
分析 ①电子层越多,原子半径越大;同周期原子序数大的原子半径小;
②非金属性越强,对应氢化物越稳定;
③非金属性越强,对应阴离子的还原性越弱;
④非金属性越强,对应最高价含氧酸的酸性越强.
解答 解:①电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径为Na>Al>N,故正确;
②非金属性F>O>S,对应氢化物的稳定性为HF>H2O>H2S,故错误;
③非金属性F>Cl>S,对应阴离子的还原性为S2->Cl->F-,故正确;
④非金属性Cl>S>P,对应最高价含氧酸的酸性为H3PO4<H2SO4<HClO4,故错误;
故选B.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
15.M、Q、R、V为分别占有前3周期的元素,其原子序数依次增加,M和R、Q和V属于同一主族,且它们的最外层电子数之和为14,下列说法中正确的是( )
| A. | 单质的沸点:M>Q | |
| B. | Q元素的阴离子和V元素的阴离子都只有还原性 | |
| C. | Q与R可以组成2种离子化合物 | |
| D. | M、Q、R、V四种元素组成的化合物的水溶液可以是碱性、中性和酸性 |
16.在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是( )
| A. | 滴加甲基橙试液显红色的溶液Fe3+、NH4+、SCN- | |
| B. | pH值为1的溶液Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液K+、HCO3-、NO3-、Al3+ |
11.已知H3PO3为二元酸,为中强酸,而H3AsO3的酸性与H3PO3差异很大,为极弱的酸.下列描述中不正确的是( )
| A. | H3PO3的结构为 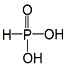 | |
| B. | H3AsO3的结构为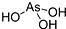 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
1.下列物质中,摩尔质量最大的是( )
| A. | 1 g Na2CO3 | B. | 0.1mol CaCO3 | C. | 56 g Fe | D. | 10 mLH2O |
8.下列互为同分异构体的是( )
| A. | CO(NH2)2、NH4CNO | B. | 白磷、红磷 | C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H | D. | CH3CH2CH2CH3、 |
5.下列关于有机化合物的认识不正确的是( )
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
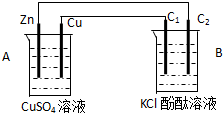 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题