题目内容
14.有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20;只有C、E是金属元素;A和E元素原子的最外层电子都只有一个;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;C元素原子的最外层电子数是D元素原子最外层电子数的一半.回答下列问题:(1)A、B的元素符号分别为:H、O.
(2)D元素最高价氧化物对应的水化物的分子式为H2SO4,E元素最高价氧化物对应的水化物含有的化学键类型为离子键、共价键.
(3)D与E形成的化合物属于离子化合物(填“离子化合物”或“共价化合物”).
(4)写出C的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
分析 A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,B和D元素原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,故B为氧元素、D为硫元素;只有C、E是金属元素,A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E为K元素、A为氢元素;C元素原子的最外层电子数是D(硫)元素原子最外层电子数的一半,最外层电子数为3,结合原子序数可知C为Al,据此解答.
解答 解:A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,B和D元素原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,故B为氧元素、D为硫元素;只有C、E是金属元素,A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E为K元素、A为氢元素;C元素原子的最外层电子数是D(硫)元素原子最外层电子数的一半,最外层电子数为3,结合原子序数可知C为Al.
(1)由上述分析可知,A为H元素、B为O元素,故答案为:H;O;
(2)D为S元素,高价氧化物对应的水化物的分子式为H2SO4,E为K元素,最高价氧化物对应的水化物为KOH,含有离子键、共价键,
故答案为:H2SO4;离子键、共价键;
(3)D与E形成的化合物为Na2S,属于离子化合物,
故答案为:离子化合物;
(4)Al与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评 本题考查结构性质位置关系,根据核外电子排布推断元素是解答的关键,熟练掌握元素元素周期表与元素化合物知识.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
5.下列关于有机化合物的认识不正确的是( )
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
2.为清理高速公路上的积雪使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为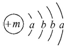 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=20,该融雪剂的化学式为CaCl2.
(2)Z、W元素的名称为硫、碳.
(3)下列说法正确的是B
A.XY2和WZ2都为离子化合物 B.XY2分子中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)已知元素的电负性与元素的化合价一样,也是元素的一种基本性质.如表给出14种元素的电负性.
根据以上的数据,可推知元素的电负性具有的变化规律是在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化.
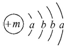 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.(1)m=20,该融雪剂的化学式为CaCl2.
(2)Z、W元素的名称为硫、碳.
(3)下列说法正确的是B
A.XY2和WZ2都为离子化合物 B.XY2分子中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)已知元素的电负性与元素的化合价一样,也是元素的一种基本性质.如表给出14种元素的电负性.
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
19.下列排列中顺序错误的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 热稳定性:H2S>H2O>PH3>NH3 | D. | 原子半径:Na>S>O>F |
3.下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
| A. | 2NaCl(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O | |
| D. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O |
 ⑥
⑥ ⑦H2 ⑧D2 ⑨O2 ⑩O3⑪${\;}_{6}^{12}$C⑫${\;}_{6}^{13}$C
⑦H2 ⑧D2 ⑨O2 ⑩O3⑪${\;}_{6}^{12}$C⑫${\;}_{6}^{13}$C 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题