题目内容
20. 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:步骤1:向废液中加入足量的NaCl溶液,将所得沉淀过滤,并洗涤干净.
步骤2:将沉淀放入烧杯,并放入铝片,再加入20%的Na2CO3溶液至浸没固体,加热搅拌,至沉淀变为灰白色[含有Ag、Al(OH)3和少量仍未反应的AgCl].取出铝片,过滤并洗涤沉淀.
步骤3:…
(1)步骤1中检验所加NaCl溶液已经足量的方法是静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量.
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体.写出该过程中发生反应的离子方程式:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑.
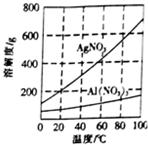
(3)已知AgNO3和Al(NO3)3的溶解度曲线如图所示,请补充完整由步骤2中所得灰白色沉淀制取硝酸银晶体的实验方案:向所得灰白色混合物中加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥,得到硝酸银晶体(实验中必须使用的试剂有:稀盐酸、稀硝酸、冰水).
(4)已知:Ag++SCN-═AgSCN↓(白色).实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应):
①称取2.000g制备的需要样品,加水溶解,定容到100mL溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有100mL容量瓶、胶头滴管.
②准确量取25.00mL溶液,酸化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000mol•L-1NH4SCN标准溶液滴定.滴定终点的实验现象为溶液变为(血)红色.
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为29.00mL.则硝酸银的质量分数为98.60%.
分析 (1)步骤1中向上清液中继续加NaCl溶液看是否有沉淀,可判断所加氯化钠是否足量;
(2)步骤2加热时产生的能使澄清石灰水变浑浊的气体为二氧化碳,反应生成了Ag、Al(OH)3,由电荷守恒可知应生成NaCl,根据元素守恒应有水参加反应,结合原子守恒和电荷守恒书写;
(3)硝酸银溶解度随温度升高而增大且受温度影响比较大,而硝酸铝溶解度受温度影响不大,可向沉淀中加入足量稀盐酸,过滤,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液;
③计算消耗NH4SCN的物质的量,根据Ag++SCN-=AgSCN↓可求得硝酸银的质量,进而确定质量分数.
解答 解:(1)步骤1中检验所加NaCl溶液已经足量的方法是:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量,
故答案为:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量;
(2)步骤2加热时产生的能使澄清石灰水变浑浊的气体为二氧化碳,反应生成了Ag、Al(OH)3,由电荷守恒可知应生成NaCl,根据元素守恒应有水参加反应,反应离子方程式为:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑,
故答案为:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑;
(3)步骤2中所得灰白色沉淀主要含有Ag、Al(OH)3和少量仍未反应的AgCl,可向沉淀中加入足量稀盐酸,充分反应后,过滤,洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体,
故答案为:加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,所以滴定终点的实验现象为:溶液变为(血)红色,
故答案为:溶液变为(血)红色;
③NH4SCN标准溶液的平均体积为29.00mL,则NH4SCN的物质的量为0.1000mol•L-1×0.029L=2.9×10-3 mol,根据Ag++SCN-=AgSCN↓可知硝酸银的质量为2.9×10-3 mol×170g/mol×$\frac{100mL}{25mL}$=1.972g,所以硝酸银的质量分数为$\frac{1.972g}{2.000g}$×100=98.60%,
故答案为:98.60%.
点评 本题考查制备实验方案的设计,涉及氧化还原反应、物质的分离提纯、物质含量测定、沉淀滴定原理应用等,综合性较强,基本属于拼合型题目,题目难度中等.

| A. |  苯的溴代反应 | B. |  乙酸丁酯的制备 | C. |  苯的硝化反应 | D. |  乙炔的制取 |
| A. | H3PO3的结构为 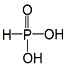 | |
| B. | H3AsO3的结构为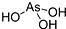 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
| A. | CO(NH2)2、NH4CNO | B. | 白磷、红磷 | C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H | D. | CH3CH2CH2CH3、 |
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
| A. | 充电时作阳极,放电时作负极 | B. | 充电时作阳极,放电时作正极 | ||
| C. | 充电时作阴极,放电时作负极 | D. | 充电时作阴极,放电时作正极 |
| A. | 2V L | B. | 2.5VL | C. | 3VL | D. | 无法计算 |
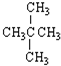 ⑥
⑥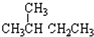 ⑦H2 ⑧D2 ⑨O2 ⑩O3⑪${\;}_{6}^{12}$C⑫${\;}_{6}^{13}$C
⑦H2 ⑧D2 ⑨O2 ⑩O3⑪${\;}_{6}^{12}$C⑫${\;}_{6}^{13}$C