题目内容
13.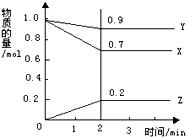 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
分析 由图可知,2min内X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物,Z为生成物,结合物质的量的变化量之比等于化学计量数之比确定化学方程式.反应开始至2min,Z的物质的量增多0.2mol,结合v=$\frac{△c}{△t}$计算.
解答 j解:由图可知,2min内X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物,Z为生成物,
X、Y、Z的物质的量变化量之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,
由物质的量的变化量之比等于化学计量数之比,且2min时达到化学平衡,则化学反应方程式为X+3Y?2Z,
反应开始至2min,Z的物质的量增多0.2mol,则v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L.min),
故答案为:X+3Y?2Z,0.05mol/(L.min).
点评 本题考查物质的量随时间变化曲线及计算,为高频考点,把握图中物质的量变化、速率和浓度计算等为解答的关键,侧重分析与计算能力的考查,注意判断2min时反应达到平衡状态,题目难度不大.

练习册系列答案
相关题目
12.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 还原性 B>A>D>C |
1.下列物质中,摩尔质量最大的是( )
| A. | 1 g Na2CO3 | B. | 0.1mol CaCO3 | C. | 56 g Fe | D. | 10 mLH2O |
8.下列互为同分异构体的是( )
| A. | CO(NH2)2、NH4CNO | B. | 白磷、红磷 | C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H | D. | CH3CH2CH2CH3、 |
5.下列关于有机化合物的认识不正确的是( )
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
2.为清理高速公路上的积雪使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为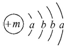 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=20,该融雪剂的化学式为CaCl2.
(2)Z、W元素的名称为硫、碳.
(3)下列说法正确的是B
A.XY2和WZ2都为离子化合物 B.XY2分子中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)已知元素的电负性与元素的化合价一样,也是元素的一种基本性质.如表给出14种元素的电负性.
根据以上的数据,可推知元素的电负性具有的变化规律是在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化.
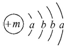 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.(1)m=20,该融雪剂的化学式为CaCl2.
(2)Z、W元素的名称为硫、碳.
(3)下列说法正确的是B
A.XY2和WZ2都为离子化合物 B.XY2分子中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)已知元素的电负性与元素的化合价一样,也是元素的一种基本性质.如表给出14种元素的电负性.
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
3.下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
| A. | 2NaCl(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O | |
| D. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O |