题目内容
19.五种短周期元素A、B、C、D、E的原子序数依次增大,其中只有C为金属元素.A和C同主族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:(1)五种元素中,原子半径最大的是Na,非金属性最强的是Cl(填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是PH3(用化学式表示);
(3)D在周期表的位置为第三周期ⅤA族
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为NH4Cl,该化合物溶于水,显酸性(填“酸”、“碱”、“中”)原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
(5)D和E可形成一种所有原子都满足8电子结构的化合物,其化学式为PCl3.
分析 五种短周期元素A、B、C、D、E的原子序数依次增大.A和B、D、E均能形成共价型化合物,A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为H元素、B为N元素,B和D同族,可知D为P;A和C同族,C离子和B离子具有相同的电子层结构,其中只有C为金属元素,可知C为Na元素;C和E形成的化合物在水中呈中性,则E为Cl元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大.A和B、D、E均能形成共价型化合物,A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为H元素、B为N元素,B和D同族,可知D为P;A和C同族,C离子和B离子具有相同的电子层结构,其中只有C为金属元素,可知C为Na元素;C和E形成的化合物在水中呈中性,则E为Cl元素,
(1)五种元素中,原子半径最大的是Na,非金属性最强的是Cl,故答案为:Na;Cl;
(2)非金属性越强,氢化物越稳定,则由A和B、D、E所形成的共价型化合物中,热稳定性最差的是PH3,故答案为:PH3;
(3)D为P,在周期表的位置为第三周期ⅤA族,故答案为:第三周期ⅤA族;
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为NH4Cl,该化合物溶于水,水解显 酸性,原因是NH4++H2O?NH3.H2O+H+,
故答案为:NH4Cl;酸;NH4++H2O?NH3.H2O+H+;
(5)D和E可形成PCl3,由电子式 可知所有原子都满足8电子结构的化合物,故答案为:PCl3.
可知所有原子都满足8电子结构的化合物,故答案为:PCl3.
点评 本题考查位置、结构及性质的综合应用,为高频考点,把握元素的位置、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及周期律的应用,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
9.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为5mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择①④(填实验编号).
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
7.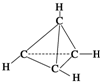 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
14.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 硅胶可用作食品干燥剂 | B. | 乙醇可作消毒剂 | ||
| C. | 氢氧化铝可作胃酸中和剂 | D. | 二氧化碳可作钠着火的灭火剂 |
4.用锌块与30mL3mol/L盐酸反应制取H2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL3mol/L盐酸
②改用30mL6mol/L盐酸
③改用粉末状锌
④适当升高温度
⑤加入几滴CuSO4溶液.
①再加入30mL3mol/L盐酸
②改用30mL6mol/L盐酸
③改用粉末状锌
④适当升高温度
⑤加入几滴CuSO4溶液.
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ②③④⑤ |
8.X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
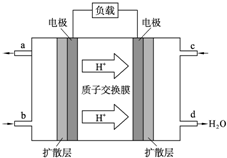 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: