题目内容
17.下列化学用语书写正确的是( )| A. | 作为相对原子质量标准的原子${\;}_{6}^{14}$C | |
| B. | 氯化镁的电子式: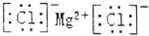 | |
| C. | 用电子式表示氯化氢分子的形成过程: | |
| D. | HClO的结构式为:H-Cl-O |
分析 A.作为相对原子质量标准的碳是质量数为12的碳原子;
B.根据晶体类型判断氯化镁为离子化合物,存在离子键,从而写出电子式;
C.氯化氢是共价化合物,不存在离子键;氯原子的电子式多1个电子;
D.HClO为O分别为H和Cl形成1对共价键.
解答 解:A.作为相对原子质量标准的原子$\underset{\stackrel{12}{\;}}{6}\underset{\stackrel{\;}{C}}{\;}$,故A错误;
B.氯化镁为离子化合物,阴阳离子间的作用力是离子键,电子式为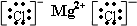 ,故B正确;
,故B正确;
C.氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程: ,故C错误;
,故C错误;
D.HClO为O分别为H和Cl形成1对共价键,结构式为H-O-Cl,故D错误;
故选B.
点评 本题考查常用化学用语的书写,题目难度不大,掌握常用化学用语的书写,注意离子化合物、共价键形成的物质的电子式书写.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
7.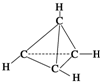 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
5.几种短周期元素的原子半径和主要化合价见下表
(1)写出Y与Q形成的化合物与氢氧化钠溶液反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(2)Z的气态氢化物的稳定性与L的气态氢化物的稳定性比较:HCl>H2S(写化学式)
(3)X、Y两种元素相比较,金属性较强的是镁(填名称),可以验证该结论的实验是bc.(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(4)上述六种元素中最高价氧化物对应的水化物酸性最强的是HClO4(填化学式)
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
(2)Z的气态氢化物的稳定性与L的气态氢化物的稳定性比较:HCl>H2S(写化学式)
(3)X、Y两种元素相比较,金属性较强的是镁(填名称),可以验证该结论的实验是bc.(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(4)上述六种元素中最高价氧化物对应的水化物酸性最强的是HClO4(填化学式)
12.A元素的阳离子与B元素的阴离子具有相同的电子层结构,下列有关两元素的叙述中正确的是( )
①原子半径:A<B
②离子半径:A>B
③原子序数:A>B
④第一电离能:A>B
⑤A的正价与B的负价绝对值一定相等
⑥电负性:A<B.
①原子半径:A<B
②离子半径:A>B
③原子序数:A>B
④第一电离能:A>B
⑤A的正价与B的负价绝对值一定相等
⑥电负性:A<B.
| A. | ③⑥ | B. | ①② | C. | ③⑤ | D. | ③④⑤⑥ |
2.绿色电源“二甲醚【(CH3)2O】-氧气燃料电池”的工作原理如图所示,下列说法正确的是( )
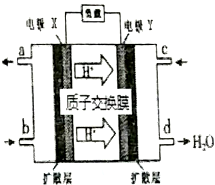

| A. | 氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O═4OH- | |
| B. | 电池在放电过程中,电极X周围溶液的pH增大 | |
| C. | 当该电池向外电路提供2 mol电子时消耗O2约为11.2L | |
| D. | 二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O═2CO2+12H+ |
6.下列叙述正确的是( )
| A. | 由于白磷和红磷都是由P元素构成的且结构不同,故白磷和红磷互称为同分异构体 | |
| B. | H2O和D2O是同素异形体 | |
| C. | CH3-CH2-CH2-CH3和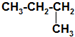 互称为同分异构体 互称为同分异构体 | |
| D. | 石英晶体是一个空间网状结构,石英晶体中不存在单个分子 |
7.向下列物质的溶液中加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,该物质是( )
| A. | MgCl2 | B. | KNO3 | C. | NaCl | D. | (NH4)2SO4 |