题目内容
9.指出下列溶液的酸碱性,并写出有关盐水解的离子方程式.(1)Na2SO4溶液:中性,无;
(2)Cu(NO3)2溶液:酸性,Cu2++2H2O?Cu(OH)2+2H+;
(3)FeCl3溶液:酸性,Fe3++3H2O?Fe(OH)3+3H+;
(4)AlCl3溶液:酸性,Al3++3H2O?Al(OH)3+3H+;
(5)Na2CO3溶液:碱性,CO32-+H2O?HCO3-+OH-,HCO3-++H2O?H2CO3+OH-;
(6)NaHSO4溶液:酸性,无.
分析 题中Cu(NO3)2、AlCl3、FeCl3为强酸弱碱盐,水解呈酸性;Na2CO3为强碱弱酸盐,水解呈碱性;Na2SO4为强酸强碱盐,不水解;NaHSO4为强酸强碱的酸式盐,电离显酸性,以此解答该题
解答 解:(1)Na2SO4为强酸强碱盐,不水解,溶液显中性,故答案为:中性;无;
(2)Cu(NO3)2是强酸弱碱盐,水解显酸性,水解的离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,故答案为:酸性;Cu2++2H2O?Cu(OH)2+2H+;
(3)FeCl3为强酸弱碱盐,水解显酸性,水解的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故答案为:酸性;Fe3++3H2O?Fe(OH)3+3H+;
(4)AlCl3为强酸弱碱盐,水解显酸性,水解的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故答案为:酸性;Al3++3H2O?Al(OH)3+3H+;
(5)Na2CO3为强碱弱酸盐,水解显碱性,离子方程式为:CO32-+H2O?HCO3-+OH-,HCO3-++H2O?H2CO3+OH-,故答案为:碱性;CO32-+H2O?HCO3-+OH-,HCO3-++H2O?H2CO3+OH-;
(6)NaHSO4为强酸强碱的酸式盐,电离显酸性,不能水解,故答案为:酸性;无.
点评 本题考查了盐类水解的条件以及规律,应注意的是盐类若水解,则必须结构中含弱离子,且谁强显谁性.

练习册系列答案
相关题目
19.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
20.下列物质的性质与应用对应关系错误的是( )
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
17.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使甲基橙变红色的溶液中:Ca2+、Mg2+、HCO3-、Cl- | |
| B. | 使KSCN变红色的溶液中:NH4+、S2-、Br-、I- | |
| C. | c(H+)/c(OH-)=1012 的溶液中:Cu2+、Al3+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)•c(OH-)=10-8的溶液中:Na+、K+、AlO2-、CO32- |
2.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起到相似作用的是Ag2SO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5.
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起到相似作用的是Ag2SO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
9.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为5mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择①④(填实验编号).
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
7.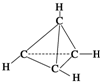 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
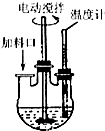 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.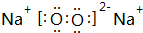 (写一种);
(写一种);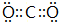 (写一种).
(写一种).