题目内容
2.氮元素可以形成多种分子和离子,如NH3、N2H4、N2-、NH4+、N2H62+等.回答以下问题:(1)N的基态原子中,有3个运动状态不同的未成对电子;
(2)某元素原子与新发现N5+分子含有相同的电子数,其基态原子的价电子排布式是4d24p4;
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有NH3,N2H4;不能作为配位体的有NH4+,N2H62+;
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是HN3分子间存在氢键;
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子的杂化类型是sp3;
②肼可用作火箭燃料时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有3mol;
(6)肼能与硫酸反应生成N2H6SO4.N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4 内微粒间作用力不存在d(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力.
分析 (1)根据氮原子的轨道表示式来解答;
(2)某元素原子与新发现N5+分子含有相同的电子数,则该元素的电子数为34,先写出基态原子的电子排布式,然后写出价电子排布式;
(3)氢键的形成原因是孤电子对与原子核之间的引力,这就要求另一个条件为原子核要小,所以一般为O,N,F原子,像NH3有一对孤电子对,N2H4有两对孤电子对,所以NH3、N2H4等能形成氢键,而NH4+、N2H62+ 中孤电子对都与H+离子共用,从而也就没有了孤电子对,没有孤电子对不能形成配位体;
(4)分子间氢键使物质的沸点升高;
(5)①根据分子中δ键数目与孤电子对数目判断;
②反应中有4mol N-H键断裂,生成1.5molN2,根据结构式N≡N判断;
③N2H6SO4晶体类型与硫酸铵相同,应含有配位键、离子键和共价键.
解答 解:(1)氮原子能量最低排布是: ,有3个运动状态不同的未成对电子,故答案为:3;
,有3个运动状态不同的未成对电子,故答案为:3;
(2)某元素原子与新发现N5+分子含有相同的电子数,某元素原子的电子数为34,该元素基态原子的电子排布式为:1s22s22p63s23p63d104s24p4,价电子排布式为:4d24p4,
故答案为:4d24p4;
(3)氢键的形成原因是孤电子对与原子核之间的引力,这就要求另一个条件为原子核要小,所以一般为O,N,F原子,像NH3有一对孤电子对,N2H4有两对孤电子对.所以NH3,N2H4等能形成氢键,而NH4+,N2H62+ 中孤电子对都与H+离子共用,从而也就没有了孤电子对;不能作为配位体的有NH4+,N2H62+,
故答案为:NH3,N2H4;NH4+,N2H62+;
(4)HN3分子间存在氢键,所以HN3在常温下是一种液体,但沸点较高,
故答案为:HN3分子间存在氢键;
(5)①由于N2H4分子中N原子形成3个δ键,且有1个孤电子对,N原子sp3杂化,
故答案为:sp3;
②N2O4+2N2H4═3N2+4H2O,若该反应中有4mol N-H键断裂,即有1mol N2H4参加反应,生成1.5mol N2,形成π键的物质的量为2×1.5mol=3mol,
故答案为:3;
(6)③肼与硫酸反应的离子方程式为N2H4+2H+═N2H62+,N2H6SO4晶体类型与硫酸铵相同,N2H62+中的化学键是共价键与配位键,N2H62+与SO42-之间是离子键,不存在范德华力,故答案为:d.
点评 本题考查考查原子结构与性质,涉及核外电子排布、杂化类型、配位键等知识,综合考查学生的分析能力和基本概念的综合运用能力,同时把氢键的来龙去脉和特点进行了彻底考查,是一道难得的好题,题目难度中等.

降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L降到0.05mol/L时,所需反应时间为( )
| A. | 等于5s | B. | 等于10s | C. | 大于10s | D. | 小于10s |
| A. | 先加硝酸酸化,再加氯化钡溶液 | B. | 先加硝酸酸化,再加硝酸钡溶液 | ||
| C. | 先加盐酸酸化,再加氯化钡溶液 | D. | 先加盐酸酸化,再加硝酸铜溶液 |
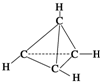 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 硅胶可用作食品干燥剂 | B. | 乙醇可作消毒剂 | ||
| C. | 氢氧化铝可作胃酸中和剂 | D. | 二氧化碳可作钠着火的灭火剂 |
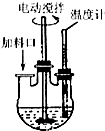 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入. 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: