题目内容
12.下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.【实验一】实验步骤如下:
| 实验序号 | 实验步骤 |
| ① | 向新制的Na2S溶液中滴加新制的氯水 |
| ② | 将镁条投入1mol/L的稀盐酸中 |
| ③ | 将铝条投入1mol/L的稀盐酸中 |
(2)实验①的现象是生成浅黄色沉淀,反应的化学方程式是Cl2+Na2S=S↓+2NaCl.
【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.
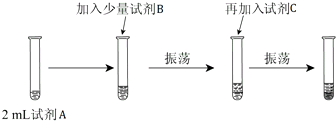
(3)试剂A是NaBr溶液;试剂B是氯水;试剂C是四氯化碳.
(4)试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,
加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色.
以上反应可以证明Cl2的非金属性强于(填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2.
分析 【实验一】(1)由实验步骤可知,比较Mg、Al的金属性强弱,S、Cl的非金属性强弱,实验目的是性质(或金属性与非金属性)的递变规律;
(2)氯水与硫化钠反应生成S与NaCl,S为淡黄色且不溶;
【实验二】根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验,要想比较氯气的氧化性大于溴的氧化性,只要使氯气和溴的盐溶液混合观察是否有溴单质生成,如果有溴单质生成就说明氯气的氧化性大于溴单质,否则不能证明.
解答 解:【实验一】(1)由实验步骤可知,实验序号①比较S、Cl的非金属性强弱,实验序号②③,比较Mg、Al的金属性强弱,所以实验目的是性质(或金属性与非金属性)的递变规律,
故答案为:性质(或金属性与非金属性)的递变规律;
(2)氯水与硫化钠反应生成S与NaCl,反应方程式为:Cl2+Na2S=S↓+2NaCl,现象:生成浅黄色沉淀,
故答案为:生成浅黄色沉淀;Cl2+Na2S=S↓+2NaCl;
【实验二】(3)要想比较氯气和溴单质的氧化性大小,做如下实验:
试剂A,取少量溴化钠反应( )→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴.
故答案为:NaBr溶液;氯水;四氯化碳;
(4)溴单质在四氯化碳中的溶解度大于在水中的溶解度,水和四氯化碳是互不相溶的,所以试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色;氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为:Cl2+2Br-=Br2+2Cl-.
故答案为:萃取生成的溴,使现象更明显;液体分成两层,上层接近无色、下层为橙色,强于 Cl2+2Br-=2Cl-+Br2.
点评 本题考查化学实验方案、元素周期律,是一道同周期元素性质的递变规律的探究题,明确实验目的、正确选取实验药品、能根据实验现象得出结论是解本题的关键,培养了学生分析和解决问题的能力,题目难度中等.

(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起到相似作用的是Ag2SO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度,适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 混合溶液/实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
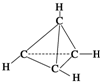 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
①再加入30mL3mol/L盐酸
②改用30mL6mol/L盐酸
③改用粉末状锌
④适当升高温度
⑤加入几滴CuSO4溶液.
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ②③④⑤ |
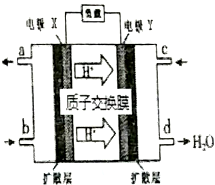
| A. | 氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O═4OH- | |
| B. | 电池在放电过程中,电极X周围溶液的pH增大 | |
| C. | 当该电池向外电路提供2 mol电子时消耗O2约为11.2L | |
| D. | 二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O═2CO2+12H+ |
 的名称(系统命名)为3,4,4一三甲基一l一戊炔.
的名称(系统命名)为3,4,4一三甲基一l一戊炔.