题目内容
10.FeCl2是一种常用的还原剂.有关数据如表:| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:
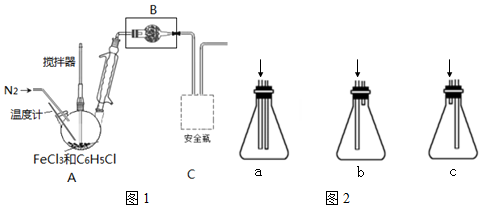
(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
分析 (1)根据仪器构造和用途可知;
(2)球形冷凝管的作用是冷凝回流,并导气;
(3)为使HCl气体全部吹入C装置中,故反应后通入N2;
(4)考虑氯化氢极易溶于水;
(5)根据2FeCl3~HCl~NaOH的关系式计算消耗的FeCl3质量,再由$\frac{转化量}{起始量}×100%$计算转化率;
(6)根据其沸点对滤液进行蒸馏可回收C6H5Cl,据此答题;
(7)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-),进而计算c(H+),结合溶液稀释前后溶质的物质的量不变计算该题.
解答 解:(1)仪器B的为球形干燥管,作用是干燥生成的HCl,故应选用酸性或中性干燥剂无水CaCl2;
故答案为:球形干燥管;无水CaCl2;
(2)球形冷凝管的作用是冷凝回流,并导出HCl气体;
故答案为:冷凝回流,导气;
(3)为使HCl气体全部吹入C装置中,使其被充分吸收,故反应后通入N2;
故答案为:将HCl气体全部吹入到C装置中,使其被充分吸收;
(4)氯化氢极易溶于水,防倒吸,选C装置;
故答案为:c;
(5)2FeCl3~HCl~NaOH,则消耗的n(FeCl3)=2n(NaOH)=2×xy×10-3mol,m(FeCl3)=2×xy×10-3×162.5g,故氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$;
故答案为:$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$;
(6)根据其沸点对滤液进行蒸馏可回收C6H5Cl,并收集132℃馏分;
故答案为:蒸馏滤液,并收集132℃馏分;
(7)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,则加入盐酸的体积至少为$\frac{0.1L×0.05mol/L}{1mol/L}$=5.0mL;
故答案为:5.0.
点评 本题考查实验室制备氯化亚铁的方案设计与评价,题目难度较大,本题注意把握实验操作原理,把握题给信息,掌握实验操作方法,学习中注意积累.

 名校课堂系列答案
名校课堂系列答案①Al ②Al2O3 ③Al(OH)3 ④NaHCO3⑤Fe(OH)3 ⑥Fe2O3.
| A. | ①②③④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②④⑥ |
| A. | 易溶于水的电解质一定是强电解质 | |
| B. | 强电解质在水溶液中以离子形式存在 | |
| C. | 难溶于水的电解质一定是弱电解质 | |
| D. | 强电解质溶液的导电性一定比弱电解质强 |
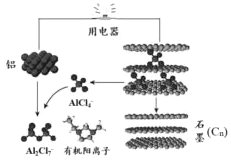 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时的阳极反应为:Cn+AlCl4--e-=CnAlCl4 | |
| B. | 放电时,铝为负极、石墨为正极 | |
| C. | 放电时,有机阳离子向铝电极方向移动 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-=4Al2Cl7- |
①蔗糖与麦芽糖
②甲醚(C2H6O)与 乙醇
③淀粉与纤维素
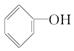
④
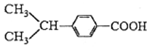 与
与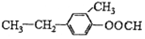
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
| A. | 用SO2漂白过的草帽日久会变色 | |
| B. | 用天燃气代替煤作燃料可减少大气污 | |
| C. | “84消毒液”杀死病菌是因为蛋白质变性 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
| A. | SiO2溶于水生成的H2SiO3的酸性弱于H2CO3 | |
| B. | SiO2是一种熔点小、硬度低的氧化物 | |
| C. | SiO2能和氢氧化钠溶液反应,因此保存氢氧化钠溶液不能用玻璃塞 | |
| D. | SiO2是一种酸性氧化物,所以不和任何酸反应 |
 B.
B.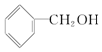 C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH
C.CH3 CH2-O-CH2CH3 D.CH3 OH E.CH3-O-CH3 F.HO-CH2CH2-OH