题目内容
15.化学与生活、社会发展息息相关.下列说法不正确的是( )| A. | 用SO2漂白过的草帽日久会变色 | |
| B. | 用天燃气代替煤作燃料可减少大气污 | |
| C. | “84消毒液”杀死病菌是因为蛋白质变性 | |
| D. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 |
分析 A.二氧化硫的漂白为暂时性的;
B.天燃气代替煤,减少固体颗粒物及N、S的氧化物排放;
C.“84消毒液”具有强氧化性;
D.体积分数为75%的酒精作医用消毒剂.
解答 解:A.二氧化硫的漂白为暂时性的,则用SO2漂白过的草帽日久会变色,故A正确;
B.天燃气代替煤,减少固体颗粒物及N、S的氧化物排放,则用天燃气代替煤作燃料可减少大气污染,故B正确;
C.“84消毒液”具有强氧化性,能使蛋白质发生变性,则“84消毒液”杀死病菌是因为蛋白质变性,故C正确;
D.在一定浓度下能使蛋白质凝固变性而杀灭细菌,最适宜的杀菌浓度为75%,因为在浓度为75%的情况下乙醇与细菌内胞液等渗,利于分布均匀杀菌,而在高浓度时(如95%),由于乙醇使细菌表面迅速脱水,会形成一层保护膜,不利于完全杀菌,故D错误;
故选D.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的性质、环境污染物及环保为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
5.分子式为C5H10的烯烃的同分异构体有多少种(要考虑顺反异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
3. 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
(1)在配制1 mol/L FeCl2溶液时,通常加入少量稀盐酸和铁粉,其原因是加酸抑制Fe2+水解,加Fe粉防止Fe2+氧化.
(2)甲同学预测电解FeCl2溶液现象:阳极和阴极分别有气泡生成.阳极的气体可能是Cl2
(3)设计实验Ⅰ验证上述猜测.实验装置和现象如下:
已知:Fe(OH)3开始沉淀时pH=1.5,完全沉淀时pH=2.8甲同学取阳极附近浑浊液于试管中,滴加KSCN溶液,没有明显变化,但是滴加少量盐酸后,溶液变成红色,说明阳极未发现Cl2生成,产物是Fe(OH)3.
(4)乙同学推测阴极未产生气体的原因可能与溶液的酸性强弱有关,设计如下对比实验:电解不同pH 的1 mol/L FeCl2溶液
由实验Ⅱ、Ⅲ得出的结论是阴极在酸性较强时,H+优先于Fe2+放电.
(5)实验Ⅰ、Ⅱ和Ⅲ均未观察到Cl2产生,乙同学继续实验探究,猜测可能是电压对实验实验的影响,设计对比实验如下:
不同电压下电解1 mol/L FeCl2溶液
①实验Ⅴ中阳极产生的Cl2将Fe2+氧化为Fe3+.有关反应方程式是Cl2+2Fe2+═2Fe3++2Cl-
②实验Ⅳ和Ⅴ中,阴极都有镀层出现,阴极的电极反应式是Fe2++2e-═Fe
(6)根据Ⅰ~Ⅴ实验探究,电解时影响离子放电顺序的因素有(写出两点):电压、溶液的酸碱性.
 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.(1)在配制1 mol/L FeCl2溶液时,通常加入少量稀盐酸和铁粉,其原因是加酸抑制Fe2+水解,加Fe粉防止Fe2+氧化.
(2)甲同学预测电解FeCl2溶液现象:阳极和阴极分别有气泡生成.阳极的气体可能是Cl2
(3)设计实验Ⅰ验证上述猜测.实验装置和现象如下:
| 序号 | 实验装置 | 阳极实验现象 | 阴极 |
| 实验Ⅰ | 电压1.5V电解1 mol/L FeCl2溶液,pH=4.9 | 阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体. | 没有观察到气泡生成,铜电极表面有银灰色金属光泽的固体析出. |
(4)乙同学推测阴极未产生气体的原因可能与溶液的酸性强弱有关,设计如下对比实验:电解不同pH 的1 mol/L FeCl2溶液
| 实验序号 | pH | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅱ | 2.4 | 无 | 未变色 | 黄绿色,少量浑浊 | 无 | 有 |
| 实验Ⅲ | -0.4 | 无 | 未变色 | 黄绿色,无浑浊 | 有 | 无 |
(5)实验Ⅰ、Ⅱ和Ⅲ均未观察到Cl2产生,乙同学继续实验探究,猜测可能是电压对实验实验的影响,设计对比实验如下:
不同电压下电解1 mol/L FeCl2溶液
| 实验序号 | 电压 (V) | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅳ | 3 | 无 | 未变色 | 缓慢变成黄绿色,有浑浊 | 少量 | 有,约1min |
| 实验Ⅴ | 6 | 少量 | 变蓝 | 很快变成黄绿色,有浑浊 | 大量 | 有,迅速 |
②实验Ⅳ和Ⅴ中,阴极都有镀层出现,阴极的电极反应式是Fe2++2e-═Fe
(6)根据Ⅰ~Ⅴ实验探究,电解时影响离子放电顺序的因素有(写出两点):电压、溶液的酸碱性.
10.FeCl2是一种常用的还原剂.有关数据如表:
查阅资料知:氯化铁遇水剧烈水解.实验室可以用如下方法来制备无水FeCl2.
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:
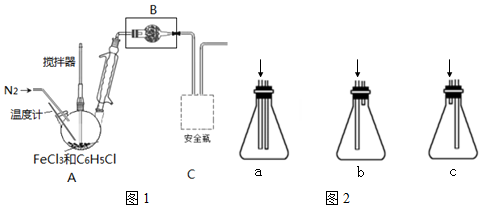
(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:

(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
20.下列叙述正确的是( )
| A. | 某溶液中加入氯化钡溶液有白色沉淀生成,且沉淀不溶于稀盐酸,则原溶液一定含有SO42- | |
| B. | 某溶液中加入盐酸放出能使澄清的石灰水变浑浊的无色无味的气体,则原溶液一定含有CO32- | |
| C. | 检验某溶液中是否含有Fe3+时,可滴加硫氰化钾溶液,若溶液由无色变为血红色,则说明溶液中一定含有Fe3+ | |
| D. | 某溶液进行焰色反应,火焰颜色呈黄色,说明原溶液中一定不存在钾离子 |
19.下列各组离子一定能大量共存的是( )
| A. | 澄清透明的无色溶液:MnO4-、Na+、I-、Mg2+ | |
| B. | 含有0.1mol/L Fe3+的溶液中:Na+、Ca2+、SCN-、SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32-、SO42-、Na+、NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+、Cl-、NO3-、Ba2+ |
 2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.
2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.