题目内容
5.下列两种化合物互为同分异构体的是( )①蔗糖与麦芽糖
②甲醚(C2H6O)与 乙醇
③淀粉与纤维素
④
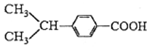 与
与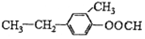
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
分析 同分异构体是指分子式相同,但结构不同的化合物,同分异构体包含碳链异构、官能团异构、位置异构等,以此来解答.
解答 解:①蔗糖和麦芽糖的分子式都为C12H22O11,蔗糖水解生成葡萄糖和果糖,麦芽糖水解生成葡萄糖,二者结构不同,互为同分异构体,故正确;
②甲醚(C2H6O)与乙醇的分子式都为C2H6O,甲醚含有醚键,乙醇含有-OH,二者结构不同,互为同分异构体,故正确;
③淀粉和纤维素的分子式为(C6H10O5)n,聚合度n不同,分子式不同,所以不是同分异构体,故错误;
④ 与
与 的分子式相同,含有的官能团不同,则结构式不同,所以互为同分异构体,故正确;
的分子式相同,含有的官能团不同,则结构式不同,所以互为同分异构体,故正确;
故选C.
点评 本题考查了同分异构体的判断、有机物的结构,难度不大,注意对同分异构体定义的理解,注意同分异构体、同素异形体、同系物、同位素的区别.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
15.已知热化学方程式:2H2(g)+O2(g)═2H2O(g)△H1═-483.6kJ•mol-1,则对于热化学方程式:2H2O(1)=2H2(g)+O2(g)△H2═QkJ•mol-1.下列关于Q值的判断正确的是( )
| A. | Q=483.6 | B. | Q>483.6 | C. | Q<483.6 | D. | 无法确定 |
16.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体.下列指定溶液中微粒浓度大小比较正确的是( )
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
13.如图为实验室制取氨气的实验装置图.下列说法错误的是( )
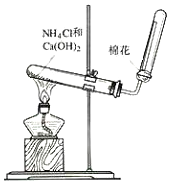

| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
10.FeCl2是一种常用的还原剂.有关数据如表:
查阅资料知:氯化铁遇水剧烈水解.实验室可以用如下方法来制备无水FeCl2.
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:
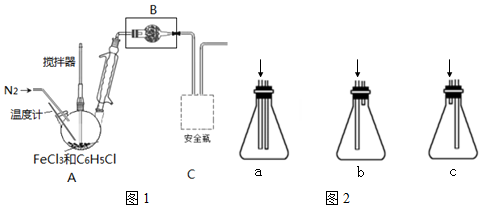
(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:

(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
17.碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图:
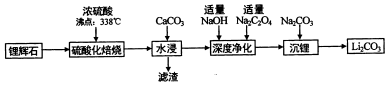
已知:碳酸锂的溶解度为((g/L)
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.

已知:碳酸锂的溶解度为((g/L)
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.
10.下列离子方程式书写不正确的是( )
| A. | 显蓝色的淀粉溶液中通入足量的SO2后变成无色溶液:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OHˉ═CaCO3↓+H2O | |
| D. | 盛放烧碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |