题目内容
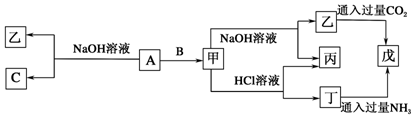
20.下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的化合物是( )①Al ②Al2O3 ③Al(OH)3 ④NaHCO3⑤Fe(OH)3 ⑥Fe2O3.
| A. | ①②③④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②④⑥ |
分析 根据物质的性质进行解答,中学常见既能与酸又能与碱反应的物质有:铝、两性氧化物、两性氢氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等.
解答 解:①铝与盐酸反应生成氯化铝和氢气;与氢氧化钠反应生成偏铝酸钠和氢气,但铝是单质,故①不选;
②氧化铝是两性氧化物,既与盐酸反应又能与氢氧化钠溶液反应,故②选;
③Al(OH)3是两性氢氧化物,既能跟盐酸反应,又能跟NaOH溶液反应,故③选;
④碳酸氢钠属于弱酸酸式盐,与盐酸反应生成氯化钠、二氧化碳与水,与氢氧化钠反应生成碳酸钠与水,故④选;
⑤Fe(OH)3 是弱碱只与盐酸反应,不与碱反应,故⑤不选;
⑥Fe2O3是碱性氧化物,只与酸反应生成盐与水,故⑥不选;
故选B.
点评 本题考查元素化合物性质,比较基础,掌握物质的性质是关键,侧重对基础知识的巩固.

练习册系列答案
相关题目
10.Na2CO3和NaHCO3是金属钠常见的两种碳酸盐,它们广泛地应用于生产和生活中.下列有关碳酸钠和碳酸氢钠的说法中,不正确的是( )
| A. | NaHCO3能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人 | |
| B. | NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头 | |
| C. | 可以用澄清石灰水来鉴别Na2CO3溶液中和NaHCO3溶液 | |
| D. | 往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀 |
11.在反应KNO2$\stackrel{△}{→}$K2O+NO↑+O2↑(未配平)中,当生成33.6L NO(标准状况)时,被氧化的氧原子的物质的量为( )
| A. | 3 mol | B. | 1.5 mol | C. | 0.75 mol | D. | 0.6 mol |
8.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 水和植物油 | B. | 水和葡萄糖 | C. | 水和醋酸 | D. | 水和酒精 |
15.已知热化学方程式:2H2(g)+O2(g)═2H2O(g)△H1═-483.6kJ•mol-1,则对于热化学方程式:2H2O(1)=2H2(g)+O2(g)△H2═QkJ•mol-1.下列关于Q值的判断正确的是( )
| A. | Q=483.6 | B. | Q>483.6 | C. | Q<483.6 | D. | 无法确定 |
5.分子式为C5H10的烯烃的同分异构体有多少种(要考虑顺反异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
12.下列实验能成功的是( )
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
| A. | ①②③④ | B. | ③④ | C. | ②③ | D. | ②③④ |
10.FeCl2是一种常用的还原剂.有关数据如表:
查阅资料知:氯化铁遇水剧烈水解.实验室可以用如下方法来制备无水FeCl2.
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:
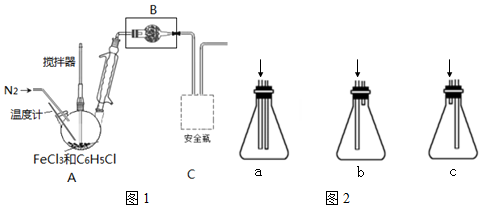
(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:

(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).