题目内容
18.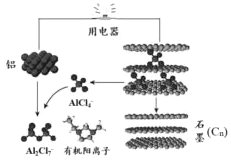 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时的阳极反应为:Cn+AlCl4--e-=CnAlCl4 | |
| B. | 放电时,铝为负极、石墨为正极 | |
| C. | 放电时,有机阳离子向铝电极方向移动 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-=4Al2Cl7- |
分析 A、充电时的阳极失电子发生氧化反应;
B、放电时,铝是活泼的金属铝是负极,不活泼石墨为正极;
C、原电池中阳离子向正极移动;
D、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-.
解答 解:A、充电时的阳极失电子氧化反应,电极反应式为:Cn+AlCl4--e-═CnAlCl4,故A正确;
B、放电时,铝是活泼的金属铝是负极,不活泼石墨为正极,故B正确;
C、原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,故C错误;
D、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故D正确;
故选C.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
8.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 水和植物油 | B. | 水和葡萄糖 | C. | 水和醋酸 | D. | 水和酒精 |
13.如图为实验室制取氨气的实验装置图.下列说法错误的是( )
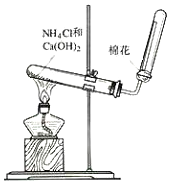

| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
3. 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
(1)在配制1 mol/L FeCl2溶液时,通常加入少量稀盐酸和铁粉,其原因是加酸抑制Fe2+水解,加Fe粉防止Fe2+氧化.
(2)甲同学预测电解FeCl2溶液现象:阳极和阴极分别有气泡生成.阳极的气体可能是Cl2
(3)设计实验Ⅰ验证上述猜测.实验装置和现象如下:
已知:Fe(OH)3开始沉淀时pH=1.5,完全沉淀时pH=2.8甲同学取阳极附近浑浊液于试管中,滴加KSCN溶液,没有明显变化,但是滴加少量盐酸后,溶液变成红色,说明阳极未发现Cl2生成,产物是Fe(OH)3.
(4)乙同学推测阴极未产生气体的原因可能与溶液的酸性强弱有关,设计如下对比实验:电解不同pH 的1 mol/L FeCl2溶液
由实验Ⅱ、Ⅲ得出的结论是阴极在酸性较强时,H+优先于Fe2+放电.
(5)实验Ⅰ、Ⅱ和Ⅲ均未观察到Cl2产生,乙同学继续实验探究,猜测可能是电压对实验实验的影响,设计对比实验如下:
不同电压下电解1 mol/L FeCl2溶液
①实验Ⅴ中阳极产生的Cl2将Fe2+氧化为Fe3+.有关反应方程式是Cl2+2Fe2+═2Fe3++2Cl-
②实验Ⅳ和Ⅴ中,阴极都有镀层出现,阴极的电极反应式是Fe2++2e-═Fe
(6)根据Ⅰ~Ⅴ实验探究,电解时影响离子放电顺序的因素有(写出两点):电压、溶液的酸碱性.
 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.(1)在配制1 mol/L FeCl2溶液时,通常加入少量稀盐酸和铁粉,其原因是加酸抑制Fe2+水解,加Fe粉防止Fe2+氧化.
(2)甲同学预测电解FeCl2溶液现象:阳极和阴极分别有气泡生成.阳极的气体可能是Cl2
(3)设计实验Ⅰ验证上述猜测.实验装置和现象如下:
| 序号 | 实验装置 | 阳极实验现象 | 阴极 |
| 实验Ⅰ | 电压1.5V电解1 mol/L FeCl2溶液,pH=4.9 | 阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体. | 没有观察到气泡生成,铜电极表面有银灰色金属光泽的固体析出. |
(4)乙同学推测阴极未产生气体的原因可能与溶液的酸性强弱有关,设计如下对比实验:电解不同pH 的1 mol/L FeCl2溶液
| 实验序号 | pH | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅱ | 2.4 | 无 | 未变色 | 黄绿色,少量浑浊 | 无 | 有 |
| 实验Ⅲ | -0.4 | 无 | 未变色 | 黄绿色,无浑浊 | 有 | 无 |
(5)实验Ⅰ、Ⅱ和Ⅲ均未观察到Cl2产生,乙同学继续实验探究,猜测可能是电压对实验实验的影响,设计对比实验如下:
不同电压下电解1 mol/L FeCl2溶液
| 实验序号 | 电压 (V) | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅳ | 3 | 无 | 未变色 | 缓慢变成黄绿色,有浑浊 | 少量 | 有,约1min |
| 实验Ⅴ | 6 | 少量 | 变蓝 | 很快变成黄绿色,有浑浊 | 大量 | 有,迅速 |
②实验Ⅳ和Ⅴ中,阴极都有镀层出现,阴极的电极反应式是Fe2++2e-═Fe
(6)根据Ⅰ~Ⅴ实验探究,电解时影响离子放电顺序的因素有(写出两点):电压、溶液的酸碱性.
10.FeCl2是一种常用的还原剂.有关数据如表:
查阅资料知:氯化铁遇水剧烈水解.实验室可以用如下方法来制备无水FeCl2.
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:
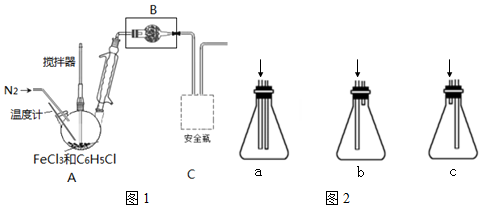
(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:

(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
3.向含有1mol KAl(SO4)2的溶液中逐滴加入Ba(OH)2溶液,充分反应,下列说法正确的是( )
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)22 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
 2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.
2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.