题目内容
1.下列关于电解质的叙述正确的是( )| A. | 易溶于水的电解质一定是强电解质 | |
| B. | 强电解质在水溶液中以离子形式存在 | |
| C. | 难溶于水的电解质一定是弱电解质 | |
| D. | 强电解质溶液的导电性一定比弱电解质强 |
分析 A.强电解质是在水溶液里完全电离的电解质;
B.强电解质是指在水溶液中完全电离的物质;
C.不完全电离的属于弱电解质,与溶解度无关;
D.溶液的导电能力与离子的浓度有关,与电解质的强弱无关.
解答 解:A.电解质的强弱和溶解度无关,乙酸、蔗糖易溶于水,但乙酸是弱酸,蔗糖为非电解质,故A错误;
B.强电解质是指在水溶液中完全电离的物质,强电解质在水溶液中以离子形式存在,故B正确;
C.不完全电离的属于弱电解质,与溶解度无关,如BaSO4不溶于水但熔融状态下完全电离,故C错误;
D.液的导电能力与离子的浓度有关,浓度越大导电能力越强,浓度越小导电能力越弱.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物,溶液的导电能力与电解质的强弱无关,如硫酸钡是强电解质,难溶于水,离子浓度小,导电能力弱,CH3COOH为弱电解质,易溶于水,当乙酸浓度比较大时,离子的浓度大,导电能力强,故D错误,
故选B.
点评 本题考查了导电能力大小与强弱电解质的关系,难度中等,注意“导电能力大小与离子浓度有关,与电解质强弱无关”是解答本题的关键.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
11.在反应KNO2$\stackrel{△}{→}$K2O+NO↑+O2↑(未配平)中,当生成33.6L NO(标准状况)时,被氧化的氧原子的物质的量为( )
| A. | 3 mol | B. | 1.5 mol | C. | 0.75 mol | D. | 0.6 mol |
12.下列实验能成功的是( )
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
| A. | ①②③④ | B. | ③④ | C. | ②③ | D. | ②③④ |
16.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体.下列指定溶液中微粒浓度大小比较正确的是( )
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
13.如图为实验室制取氨气的实验装置图.下列说法错误的是( )
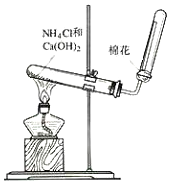

| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
10.FeCl2是一种常用的还原剂.有关数据如表:
查阅资料知:氯化铁遇水剧烈水解.实验室可以用如下方法来制备无水FeCl2.
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:
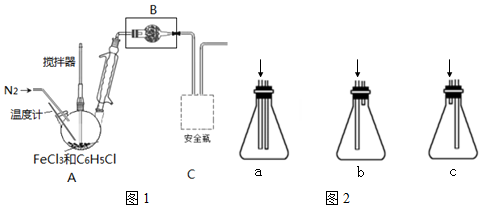
(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
按下图装置,在三颈烧瓶中放入ag无水氯化铁和过量的氯苯,控制反应温度在128~139℃加热3h,冷却,分离提纯得到粗产品.反应的化学方程式为:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
请回答下列问题:

(1)仪器B的名称球形干燥管,盛装的试剂是无水CaCl2.
(2)球形冷凝管的作用是冷凝回流,导气.
(3)反应后通入N2的目的是将HCl气体全部吹入到C装置中,使其被充分吸收.
(4)图1虚线框内应选择的安全瓶(盛有蒸馏水)是c.
(5)用x mol/L NaOH溶液滴定安全瓶中盐酸,消耗y mLNaOH溶液,则氯化铁转化率为$\frac{xy×1{0}^{-3}×2×162.5}{a}×100%$(列出计算式).
(6)冷却实验装置如图2,将三颈烧瓶内物质经过过滤、洗涤,干燥后,将得到粗产品,则回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(7)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入5.0mL、1mol/L的盐酸(总体积忽略加入盐酸体积).
6.对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间存在关系等式Ksp=c(M+)•c(X-).现将足量的AgCl分别放入下列物质中,AgCl的溶解度最大的是( )
| A. | 60 mL 0.03 mol•L-1HCl溶液 | B. | 60 mL 0.04 mol•L-1KCl溶液 | ||
| C. | 20 mL 0.03 mol•L-1CaCl2溶液 | D. | 50 mL 0.05 mol•L-1AgNO3溶液 |
 2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.
2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.