��Ŀ����
�ڸ��������£����л����ߵ������ڻ�ѧ��Ӧ���ܱ���ȫ���ĵ��ǣ�������
| A����״���£���1 g��ƬͶ��20 mL 18.4 mol?L-1�������� |
| B����100 mL 3 moI?L-1���������5.6 g�� |
| C����50 mL 18 mol?L-1Ũ����������Cu���ȣ�ָ���е����ᱻ��ȫ���ģ� |
| D����5��107 Pa��500�������ý���������£���3 mol������2 mol�����ϳɰ� |
���㣺���Ļ�ѧ����,����Ļ�ѧ����,Ũ���������
ר�⣺Ԫ�ؼ��仯����
������A����������Ũ����֮���ܷ����ۻ���
B��n��Fe��=
=0.1mol��n�����ᣩ=0.3mol��Fe����ȫ�ܽ�����������������������
C��ͭ��ϡ�����Ӧ��
D���ϳɰ���ӦΪ���淴Ӧ���ݿ��淴Ӧ���ص����ش�
B��n��Fe��=
| 5.6g |
| 56g/mol |
C��ͭ��ϡ�����Ӧ��
D���ϳɰ���ӦΪ���淴Ӧ���ݿ��淴Ӧ���ص����ش�
���
�⣺A.18.4mol?L-1������ΪŨ���ᣬ�������Al�����ۻ��������ܵ�����Ĥ��ֹ��Ӧ�Ľ�һ����������Al���ܱ���ȫ���ģ���A��ѡ��
B��n��Fe��=
=0.1mol��n�����ᣩ=0.3molmol�������ʵ�������1��4��3��8֮�䣬Fe����ȫ�ܽ�������������������������Bѡ��
C���淴Ӧ�Ľ��У�Ũ�����Ϊϡ���ᣬϡ������������̲���Ӧ�����������ȫ���ģ���C��ѡ��
D���ϳɰ���ӦΪ���淴Ӧ��������������ȫ���ģ���D��ѡ��
��ѡB��
B��n��Fe��=
| 5.6g |
| 56g/mol |
C���淴Ӧ�Ľ��У�Ũ�����Ϊϡ���ᣬϡ������������̲���Ӧ�����������ȫ���ģ���C��ѡ��
D���ϳɰ���ӦΪ���淴Ӧ��������������ȫ���ģ���D��ѡ��
��ѡB��
���������⿼�����ʵ����ʣ�Ϊ��Ƶ���㣬�������ʵ����ʼ������ķ�ӦΪ���Ĺؼ���ע��ۻ������淴Ӧ���жϣ����ػ�ѧ��Ӧ�Ŀ��飬��Ŀ�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
����˵����ȷ���ǣ�������
| A������Һ��c��OH-��=10-7 mol/L�������Һһ�������� |
| B��c��H+��Խ����pHԽ����Һ�ļ���Խǿ |
| C��pH=0����Һ������ֻ����H+������OH- |
| D����25�洿ˮ�м�����NaHSO4���¶Ȳ��䣩��c��H+����c��OH-���˻����� |
��һ�����ܱ���ƿ��ע��NO2����25��ʱ����ƽ�⣺2NO2?N2O4��H��0��������ƿ����100��ķ�ˮ�У��������������ɫ ��ƽ��Ħ������ ������ ��ѹǿ ���ܶ��в�����ǣ�������
| A���ۢ� | B���ۢ� | C���ڢ� | D���٢� |
����˵����ȷ���ǣ�������
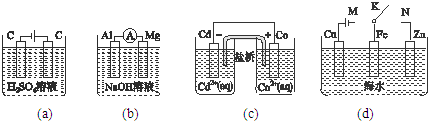

| A��ͼ��a���У����ŵ��Ľ��У���Һ��H+��Ũ��Խ��ԽС |
| B��ͼ��b���У�Mg�缫����صĸ��� |
| C��ͼ��c���У������ķ�ӦΪCo+Cd2+=Cd+Co2+ |
| D��ͼ��d���У�K�ֱ���M��N����ʱ��Fe�缫���ܵ����� |
�����й��Ȼ�ѧ����ʽ��������ȷ���ǣ�������
| A����֪2H2��gO2��g��=2H2O��g������H=-483.6 kJ/mol����������ȼ����Ϊ241.8 kJ/mol |
| B����֪C��ʯī��s��=C�����ʯ��s������H��0������ʯ��ʯī�ȶ� |
| C����20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ����������÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��aq������H=-57.4 kJ/mol |
| D����֪2C��s��+2O2��g��=2CO2��g������H1��2C��s��+O2��g��=2CO��g������H2�����H1����H2 |
�������ӷ���ʽ����ȷ���ǣ�������
| A���Ȼ�������Һ���������2��1��Ӧ��6Fe2++3 Na2O2+6 H2O=4Fe��OH��3��+6 Na++2Fe3+ |
| B�����������м�������ᷢ����Ӧ��Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C��˫��ˮ����ϡ�����KI��Һ��H2O2+2H++2I-=I2+O2��+2 H2O |
| D����������Һ�м������[Ag��NH3��2]++OH-+3H+=Ag++2NH4++H2O |
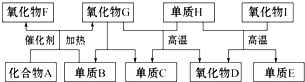
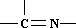 ���ֻ��ţ���״�ṹ����A����Է�������Ϊ116��������������ʱ̼ԭ�Ӹ�̼ԭ����������A�Ľṹ��ʽ��
���ֻ��ţ���״�ṹ����A����Է�������Ϊ116��������������ʱ̼ԭ�Ӹ�̼ԭ����������A�Ľṹ��ʽ��