题目内容
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用.某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下.其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段.
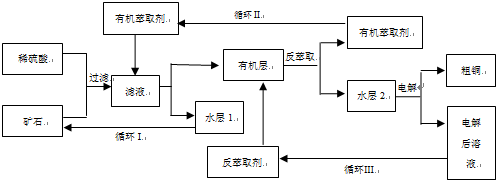
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液.回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O (写其中1个).
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 .若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 .
(3)“循环II”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个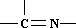 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 .
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 .
(4)“循环Ⅲ”中反萃取剂的主要成分是 .

已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液.回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是
(3)“循环II”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个
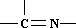 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是(4)“循环Ⅲ”中反萃取剂的主要成分是
考点:金属冶炼的一般原理,铜金属及其重要化合物的主要性质,有机物的推断
专题:几种重要的金属及其化合物,有机物分子组成通式的应用规律
分析:(1)氧化铜、三氧化二铁均可以和强酸发生反应生成盐和水,金属铜和三价铁之间发生氧化还原反应;
(2)一定条件下,硫酸亚铁经常以FeSO4?7H2O的形式存在,亚铁离子易被氧化为三价铁离子;
(3)肟类的有机化合物是具有肟基(C=NOH)的有机化合物;
(4)根据循环图找出循环Ⅲ大反萃取剂.
(2)一定条件下,硫酸亚铁经常以FeSO4?7H2O的形式存在,亚铁离子易被氧化为三价铁离子;
(3)肟类的有机化合物是具有肟基(C=NOH)的有机化合物;
(4)根据循环图找出循环Ⅲ大反萃取剂.
解答:
解:(1)氧化铜、三氧化二铁均可以和强酸发生反应生成盐和水,CuO+2H+═Cu2++H2O、Fe2O3+6H+═2Fe3++3H2O,金属铜和三价铁之间发生氧化还原反应,即Cu+2Fe3+═2Fe2++Cu2+,
故答案为:CuO+2H+═Cu2++H2O、Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ (任写两个即可);
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的晶体FeSO4?7H2O,暴露在空气中一段时间后,可被氧气氧化,4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:FeSO4?7H2O;4Fe2++O2+4H+═4Fe3++2H2O;
(3))-CH3、-OH是端头基, 是分子的骨架,一个
是分子的骨架,一个 就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2;n3=n1+n2-2;
就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2;n3=n1+n2-2;
依据分析判断出的取代基,若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,得到结构简式为:CH3-C(=N-OH)-C(=N-OH)-CH3;
故答案为:CH3-C(=N-OH)-C(=N-OH)-CH3;
(4)“循环Ⅲ”中反萃取剂的主要成分是硫酸,故答案为:H2SO4.
故答案为:CuO+2H+═Cu2++H2O、Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+ (任写两个即可);
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的晶体FeSO4?7H2O,暴露在空气中一段时间后,可被氧气氧化,4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:FeSO4?7H2O;4Fe2++O2+4H+═4Fe3++2H2O;
(3))-CH3、-OH是端头基,
 是分子的骨架,一个
是分子的骨架,一个 就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2;n3=n1+n2-2;
就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2;n3=n1+n2-2; 依据分析判断出的取代基,若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,得到结构简式为:CH3-C(=N-OH)-C(=N-OH)-CH3;
故答案为:CH3-C(=N-OH)-C(=N-OH)-CH3;
(4)“循环Ⅲ”中反萃取剂的主要成分是硫酸,故答案为:H2SO4.
点评:本题考查化学实验方案的设计,为高频考点,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
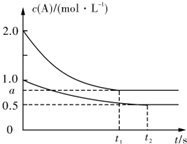 向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:
向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<O.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1molA 1molB | 0.5molA 0.5molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充人0.2mol A、0.2mol B、0.2mol C,则此时v(正)>v(逆) |
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )
| A、用量筒量取浓盐酸配制0.1mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 |
| B、配制稀盐酸定容时,俯视容量瓶刻度线 |
| C、滴定前尖嘴处无气泡,滴定终点时有气泡 |
| D、滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下 |
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.