题目内容
下列离子方程式中正确的是( )
| A、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3 Na2O2+6 H2O=4Fe(OH)3↓+6 Na++2Fe3+ |
| B、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+O2↑+2 H2O |
| D、向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O |
考点:离子方程式的书写
专题:
分析:A.氯化亚铁溶液与过氧化钠2:1反应,生成氢氧化铁、氯化钠、氯化铁;
B.电荷不守恒;
C.原子个数不守恒;
D.银氨溶液中加入盐酸,反应生成氯化银、氯化铵和水.
B.电荷不守恒;
C.原子个数不守恒;
D.银氨溶液中加入盐酸,反应生成氯化银、氯化铵和水.
解答:
解:A.氯化亚铁溶液与过氧化钠2:1反应,离子方程式:6Fe2++3 Na2O2+6 H2O=4Fe(OH)3↓+6 Na++2Fe3+,故A正确;
B.向氧化铁中加入氢碘酸发生反应,离子方程式:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故B错误;
C.双氧水加入稀硫酸和KI溶液,离子方程式:H2O2+2H++2I-=I2+2H2O,故C错误;
D.向银氨溶液中加入盐酸,离子方程式:[Ag(NH3)2]++Cl-+3H+=AgCl↓+2NH4++H2O,故D错误;
故选:A.
B.向氧化铁中加入氢碘酸发生反应,离子方程式:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故B错误;
C.双氧水加入稀硫酸和KI溶液,离子方程式:H2O2+2H++2I-=I2+2H2O,故C错误;
D.向银氨溶液中加入盐酸,离子方程式:[Ag(NH3)2]++Cl-+3H+=AgCl↓+2NH4++H2O,故D错误;
故选:A.
点评:本题考查了离子方程式的书写,明确发生反应实质是解本题关键,选项AD为易错选项.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )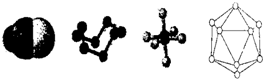

| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6为正八面体的非极性分子 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
关于O2与O3气体,下列比值一定为2:3的是( )
| A、若温度和压强相同,两种气体的密度之比 |
| B、当两种气体所占体积相同,所含氧原子数之比 |
| C、若两种气体原子数相同,两种气体的质子数之比 |
| D、若两种气体的质量相同,两种气体的分子数之比 |
下列解释实验现象的反应方程式不正确的是( )
| A、SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO3+H2O |
| B、用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ |
| C、等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、用Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-═CaCO3↓ |
使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )
| A、用量筒量取浓盐酸配制0.1mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 |
| B、配制稀盐酸定容时,俯视容量瓶刻度线 |
| C、滴定前尖嘴处无气泡,滴定终点时有气泡 |
| D、滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下 |
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率v(PCl3)=0.0032mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol?L-1,则反应的△H<0 |
| C、相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前v(正)>v(逆) |
| D、相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |