题目内容
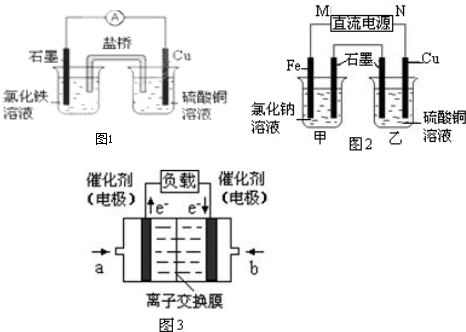
如图所示的框图中,A~I都是由短周期元素组成的常见物质.其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料.
(1)化合物A的化学式是 .
(2)组成单质E的元素在元素周期表中的位置是 ;H+I反应的化学方程式为 .
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH= .此时再向溶液中通入2.24L化合物A,完全反应后所得溶液的pH<7,用离子方程式表示其原因: .
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为 .

(1)化合物A的化学式是
(2)组成单质E的元素在元素周期表中的位置是
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH=
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为
考点:无机物的推断
专题:
分析:A是气体,它的水溶液呈碱性,则A应为NH3,与单质B在催化剂条件下反应生成两种氧化物,则B为O2;
氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒,则F为NO、D为CO,G为H2O;
结合转化关系可知C为H2、H为C,单质E可作半导体材料,应为Si,则I为SiO2,
根据分析可知:A应为NH3、B为O2、C为H2、D为CO、E为Si、F为NO、G为H2O、H为C、I为SiO2,
结合对应物质的性质以及题目要求可解答该题.
氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒,则F为NO、D为CO,G为H2O;
结合转化关系可知C为H2、H为C,单质E可作半导体材料,应为Si,则I为SiO2,
根据分析可知:A应为NH3、B为O2、C为H2、D为CO、E为Si、F为NO、G为H2O、H为C、I为SiO2,
结合对应物质的性质以及题目要求可解答该题.
解答:
解:A是气体,它的水溶液呈碱性,应为NH3,与单质B在催化剂条件下反应生成两种氧化物,则B为O2,氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒,则F为NO,D为CO,G为H2O,结合转化关系可知C为H2,H为C,单质E可作半导体材料,应为Si,则I为SiO2,
(1)由以上分析可知A为NH3,
故答案为:NH3;
(2)E为Si,位于周期表第三周期IVA族;H为C、I为SiO2,单质C和氧化物SiO2在高温下反应生成硅和一氧化碳,反应的化学方程式为SiO2+2C
Si+2CO↑,
故答案为:第三周期IVA族;SiO2+2C
Si+2CO↑;
(3)F为NO、B为O2,将2.24L氧化物F和1.68L单质B的物质的量之比为2.24:1.68=4:3,通入水中发生反应:4NO+3O2+2H2O=4HNO3,n(HNO3)=n(NO)=0.1mol,c(HNO3)=0.1mol/L,则溶液的pH=1;
此时再向溶液中通入2.24L化合物A,得到硝酸铵溶液,为强酸弱碱盐,水解呈酸性,离子方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:1;NH4++H2O?NH3?H2O+H+;
(4)碱性氢氧燃料电池中,负极发生氧化反应,电极方程式为:H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O.
(1)由以上分析可知A为NH3,
故答案为:NH3;
(2)E为Si,位于周期表第三周期IVA族;H为C、I为SiO2,单质C和氧化物SiO2在高温下反应生成硅和一氧化碳,反应的化学方程式为SiO2+2C
| ||
故答案为:第三周期IVA族;SiO2+2C
| ||
(3)F为NO、B为O2,将2.24L氧化物F和1.68L单质B的物质的量之比为2.24:1.68=4:3,通入水中发生反应:4NO+3O2+2H2O=4HNO3,n(HNO3)=n(NO)=0.1mol,c(HNO3)=0.1mol/L,则溶液的pH=1;
此时再向溶液中通入2.24L化合物A,得到硝酸铵溶液,为强酸弱碱盐,水解呈酸性,离子方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:1;NH4++H2O?NH3?H2O+H+;
(4)碱性氢氧燃料电池中,负极发生氧化反应,电极方程式为:H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O.
点评:本题考查无机物的推断,题目难度中等,为高频考点,侧重考查学生的分析、分析能力及综合应用所学知识能力,注意把握物质的性质以及转化关系,为解答该题的关键.

练习册系列答案
相关题目
下列属于电解质并能导电的物质是( )
| A、熔融的NaCl |
| B、KNO3溶液 |
| C、干冰 |
| D、金属铝 |
下列实验操作中不正确的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、氢气还原氧化铜实验中先通氢气再加热实验结束时应先停止加热,继续通氢气至固体冷却 |
| C、配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却 |
| D、用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中 |
16.8g NaHCO3和7.8g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是( )
| A、Na2CO3,Na2O,O2 |
| B、Na2CO3,CO2,O2,H2O(g) |
| C、Na2CO3,O2,H2O(g) |
| D、NaHCO3,Na2CO3,O2 |
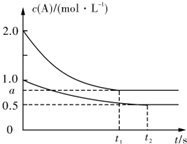 向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:
向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<O.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1molA 1molB | 0.5molA 0.5molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充人0.2mol A、0.2mol B、0.2mol C,则此时v(正)>v(逆) |
将20mL0.4mol?L-1硝酸铵溶液跟50mL0.1mol?L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
| A、[NO3-]>[OH-]>[NH4+]>[Ba2+] |
| B、[NO3-]>[Ba2+]>[OH-]>[NH4+] |
| C、[Ba2+]>[NO3-]>[OH-]>[NH4+] |
| D、[NO3-]>[Ba2+]>[NH4+]>[OH-] |
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |