题目内容
下列说法正确的是( )
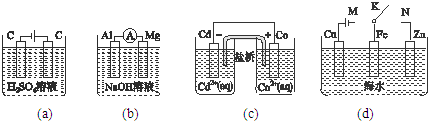

| A、图(a)中,随着电解的进行,溶液中H+的浓度越来越小 |
| B、图(b)中,Mg电极作电池的负极 |
| C、图(c)中,发生的反应为Co+Cd2+=Cd+Co2+ |
| D、图(d)中,K分别与M、N连接时,Fe电极均受到保护 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.图a中,实际上为电解水;
B.图b中,铝与氢氧化钠溶液发生反应,铝发生氧化反应,原电池负极发生氧化反应;
C.图c中,负极上失电子,正极上得电子,较活泼的金属为负极,较不活泼的金属为正极,据此写出电池反应式;
D.图d中,K与M连接,连接电源的负极,Fe作阴极被保护,K分别与N连接,形成原电池,Fe为正极被保护.
B.图b中,铝与氢氧化钠溶液发生反应,铝发生氧化反应,原电池负极发生氧化反应;
C.图c中,负极上失电子,正极上得电子,较活泼的金属为负极,较不活泼的金属为正极,据此写出电池反应式;
D.图d中,K与M连接,连接电源的负极,Fe作阴极被保护,K分别与N连接,形成原电池,Fe为正极被保护.
解答:
解:A.图a中,阳极上氢氧根离子失电子,阴极上氢离子放电,溶液中氢离子浓度增大,故A错误;
B.图b中,铝与氢氧化钠溶液发生反应,铝发生氧化反应,原电池负极发生氧化反应,铝作负极,故B错误,
C.图c中,负极上失电子,发生氧化反应,正极上得电子,发生还原反应,Cd为负极,故金属活泼性Cd>Co,故发生的反应为Cd+Co2+=Co+Cd2+,故C错误;
D.图d中,K与M连接,连接电源的负极,Fe作阴极被保护,K与N连接,形成原电池,Fe为正极被保护,故D正确;
故选D.
B.图b中,铝与氢氧化钠溶液发生反应,铝发生氧化反应,原电池负极发生氧化反应,铝作负极,故B错误,
C.图c中,负极上失电子,发生氧化反应,正极上得电子,发生还原反应,Cd为负极,故金属活泼性Cd>Co,故发生的反应为Cd+Co2+=Co+Cd2+,故C错误;
D.图d中,K与M连接,连接电源的负极,Fe作阴极被保护,K与N连接,形成原电池,Fe为正极被保护,故D正确;
故选D.
点评:本题综合考查电解池和原电池知识,注意把握电化学工作原理,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.

练习册系列答案
相关题目
16.8g NaHCO3和7.8g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是( )
| A、Na2CO3,Na2O,O2 |
| B、Na2CO3,CO2,O2,H2O(g) |
| C、Na2CO3,O2,H2O(g) |
| D、NaHCO3,Na2CO3,O2 |
已知:2M(g)?N(g);△H<0.现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如图所示.下列说法正确的是( )


| A、a、b、c、d四个点中处于平衡状态的点是a、b d |
| B、反应进行至25min时,曲线发生变化的原因是加入了 0.4molN |
| C、若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
| D、若40min后出现如图所示变化,则可能是加入了某种催化剂 |
反应:PCl5(g)?PCl 3(g)+Cl2(g) ①
2HI(g)?H2(g)+I2(g) ②
2NO2(g)?N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
2HI(g)?H2(g)+I2(g) ②
2NO2(g)?N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A、均不变 |
| B、均增大 |
| C、①增大,②不变,③减少 |
| D、①减少,②不变,③增大 |
C+CO2?2CO(正反应吸热),反应速率为v1:N2+3H2?2NH3(正反应放热),反应速率为v2.对于上述反应,当温度降低时,v1和v2的变化情况是( )
| A、同时增大 |
| B、同时减小 |
| C、v1增加,v2减小 |
| D、v1减小,v2增大 |
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
下列说法不正确的是( )
| A、在室内放置一些特别的绿色植物,可用于室内空气的净化 |
| B、合金的熔点一般高于各组成成分金属的熔点 |
| C、氢氧化钠溶液用盖橡胶塞的试剂瓶盛装 |
| D、工业上用盐酸刻蚀玻璃 |
下列解释实验现象的反应方程式不正确的是( )
| A、SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO3+H2O |
| B、用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ |
| C、等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、用Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-═CaCO3↓ |



