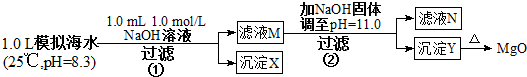
题目内容
(1)在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为 ,离子方程式为 .
(2)在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为 ,离子方程式是 .
(3)对比上述两个实验所得的结果,将I2、ClO-、SO42-按氧化性由强到弱的顺序排列为 .
(2)在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为
(3)对比上述两个实验所得的结果,将I2、ClO-、SO42-按氧化性由强到弱的顺序排列为
考点:氧化还原反应,氧化性、还原性强弱的比较
专题:
分析:次氯酸钠具有强氧化性,可氧化I-生成单质I2,I2遇淀粉变蓝;Na2SO3具有还原性,可还原I2生成I-,使蓝色消失,离子方程式的书写思路是:确定反应物、产物,然后根据电子得失守恒和电荷守恒配平,氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性.
解答:
解:(1)次氯酸钠具有强氧化性,可氧化I-生成单质I2,I2遇淀粉变蓝,反应的离子方程式为ClO-+2I-+H2O═I2+Cl-+2OH-,
故答案为:I-被次氯酸钠氧化为碘单质,单质碘遇淀粉变蓝色;ClO-+2I-+H2O═I2+Cl-+2OH-;
(2)Na2SO3具有还原性,可还原I2生成I-,使蓝色消失,反应的离子方程式为SO32-+I2+2OH-═SO42-+2I-+H2O,
故答案为:单质碘被亚硫酸钠还原为碘离子;SO32-+I2+2OH-═SO42-+2I-+H2O;
(3)氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,由①可知ClO->I2,由②可知I2>SO42-,故答案为:ClO->I2>SO42-.
故答案为:I-被次氯酸钠氧化为碘单质,单质碘遇淀粉变蓝色;ClO-+2I-+H2O═I2+Cl-+2OH-;
(2)Na2SO3具有还原性,可还原I2生成I-,使蓝色消失,反应的离子方程式为SO32-+I2+2OH-═SO42-+2I-+H2O,
故答案为:单质碘被亚硫酸钠还原为碘离子;SO32-+I2+2OH-═SO42-+2I-+H2O;
(3)氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,由①可知ClO->I2,由②可知I2>SO42-,故答案为:ClO->I2>SO42-.
点评:本题综合考查了氧化还原反应的知识,侧重于考查学生的实验设计能力,注意把握相关物质的性质,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )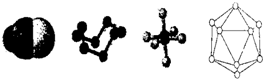

| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6为正八面体的非极性分子 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
关于O2与O3气体,下列比值一定为2:3的是( )
| A、若温度和压强相同,两种气体的密度之比 |
| B、当两种气体所占体积相同,所含氧原子数之比 |
| C、若两种气体原子数相同,两种气体的质子数之比 |
| D、若两种气体的质量相同,两种气体的分子数之比 |