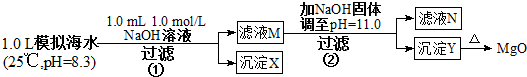
题目内容
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |
考点:热化学方程式,焓变和熵变
专题:
分析:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、依据能量守恒,物质的能量越高越活泼;
C、中和热是指强酸强碱稀溶液恰好中和反应生成1mol水放出的热量;
D、依据盖斯定律计算得到.
B、依据能量守恒,物质的能量越高越活泼;
C、中和热是指强酸强碱稀溶液恰好中和反应生成1mol水放出的热量;
D、依据盖斯定律计算得到.
解答:
解:A、2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,热化学方程式中生成的是气体水不符合燃烧热的概念,故A错误;
B、C(石墨,s)=C(金刚石,s)△H>0,依据能量守恒判断,金刚石能量高,石墨能量低,则石墨比金刚石稳定,故B错误;
C、含20.0g NaOH物质的量为0.5mol,稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,所以中和热为-57.4KJ/mol,故C错误;
D、①2C(s)+2O2(g)=2CO2(g)△H1,②2C(s)+O2(g)=2CO(g)△H2.依据盖斯定律,①-②得到2CO(g)+O2(g)=2CO2(g)的△H=△H1-△H2,故D正确;
故选D.
B、C(石墨,s)=C(金刚石,s)△H>0,依据能量守恒判断,金刚石能量高,石墨能量低,则石墨比金刚石稳定,故B错误;
C、含20.0g NaOH物质的量为0.5mol,稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,所以中和热为-57.4KJ/mol,故C错误;
D、①2C(s)+2O2(g)=2CO2(g)△H1,②2C(s)+O2(g)=2CO(g)△H2.依据盖斯定律,①-②得到2CO(g)+O2(g)=2CO2(g)的△H=△H1-△H2,故D正确;
故选D.
点评:本题考查了热化学方程式的书写方法和注意问题,主要是燃烧热、中和热概念的分析判断,能量守恒的应用,盖斯定律的计算应用,题目难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
将20mL0.4mol?L-1硝酸铵溶液跟50mL0.1mol?L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
| A、[NO3-]>[OH-]>[NH4+]>[Ba2+] |
| B、[NO3-]>[Ba2+]>[OH-]>[NH4+] |
| C、[Ba2+]>[NO3-]>[OH-]>[NH4+] |
| D、[NO3-]>[Ba2+]>[NH4+]>[OH-] |
反应:PCl5(g)?PCl 3(g)+Cl2(g) ①
2HI(g)?H2(g)+I2(g) ②
2NO2(g)?N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
2HI(g)?H2(g)+I2(g) ②
2NO2(g)?N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A、均不变 |
| B、均增大 |
| C、①增大,②不变,③减少 |
| D、①减少,②不变,③增大 |
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是( )
| A、标准状况下,将1 g铝片投入20 mL 18.4 mol?L-1的硫酸中 |
| B、向100 mL 3 moI?L-1的硝酸中加入5.6 g铁 |
| C、用50 mL 18 mol?L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗) |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
下列说法不正确的是( )
| A、在室内放置一些特别的绿色植物,可用于室内空气的净化 |
| B、合金的熔点一般高于各组成成分金属的熔点 |
| C、氢氧化钠溶液用盖橡胶塞的试剂瓶盛装 |
| D、工业上用盐酸刻蚀玻璃 |
下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )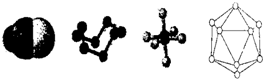

| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6为正八面体的非极性分子 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |