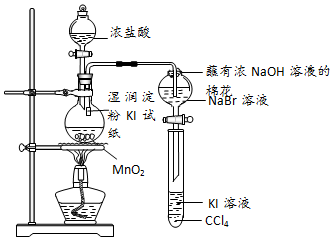
题目内容
6.简要回答下列问题(1)新装修的家居会释放出有害物质,请列举一例能减少室内空气污染的方法多开窗通风.
(2)大气中二氧化碳含量的增加引起“温室效应”,人类应采取的防止“温室效应”的措施有开发新能源.
(3)不能直接用手拿金属钠的原因是金属钠会和手上的水分反应生成氢氧化钠,腐蚀皮肤.
(4)2004年4月16日重庆某化工厂氯气池泄漏,引起氯气罐爆炸,消防人员用6个高压水枪同时喷水和稀的烧碱溶液,以防止氯气扩散,其原理是氯气能溶于水,也能与烧碱溶液反应,减少有毒气体氯气的扩散.
分析 (1)根据开窗通风可降低室内甲醛的含量分析解答;
(2)为防止温室效应增强,应减少二氧化碳的排放,可从化石燃料、新能源等角度考虑;
(3)钠为活泼金属,容易与水分反应生成具有腐蚀性的氢氧化钠;
(4)氯气能溶于水,也能与烧碱溶液反应.
解答 解:(1)开窗通风可降低室内甲醛的含量,故答案:多开窗通风;
(2)为防止温室效应增强,应减少二氧化碳的排放,少用化石燃料;限制CO2的排放;开发新能源;保护地球上的森林资源;增加城市的绿地面积等等;故答案为:开发新能源;
(3)金属钠性质非常活泼,能够与手上的水分反应生成氢氧化钠,腐蚀皮肤,所以不能用手直接拿取金属钠,
故答案为:金属钠会和手上的水分反应生成氢氧化钠,腐蚀皮肤;
(4)因为氯气能溶于水,也能与烧碱溶液反应,所以消防人员用6个高压水枪同时喷水和稀的烧碱溶液吸收泄漏的氯气,
故答案为:氯气能溶于水,也能与烧碱溶液反应,减少有毒气体氯气的扩散.
点评 本题考查常见生活环境的污染及治理,为高考常见题型和高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学生的学习的积极性,注意基础知识的积累.

练习册系列答案
相关题目
17.工业制硝酸过程中的一个重要反应为4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.下列有关该反应的说法不正确的是( )
| A. | O2是氧化剂 | B. | NH3是氧化剂 | C. | O2被还原 | D. | NH3发生氧化反应 |
14.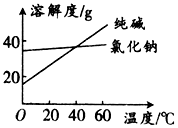 阅读分析下列材料:
阅读分析下列材料:
材料1:纯碱和氯化钠溶解度随温度变化的曲线图:
材料2:两种有机物的物理性质:
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,合适的方法是C(填字母,下同);将乙二醇和丙三醇混合液相互分离的最佳方法是:蒸馏.
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明:取样品少许于试管中,加入蒸馏水溶解,加入硝酸酸化的硝酸银溶液.出现白色沉淀,证明含有氯化钠 (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②利用方案2中的数据计算该纯碱的纯度:$\frac{53a}{50m}$×100%.
 阅读分析下列材料:
阅读分析下列材料:材料1:纯碱和氯化钠溶解度随温度变化的曲线图:
材料2:两种有机物的物理性质:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
| 丙三醇 C3H8O3 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明:取样品少许于试管中,加入蒸馏水溶解,加入硝酸酸化的硝酸银溶液.出现白色沉淀,证明含有氯化钠 (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②利用方案2中的数据计算该纯碱的纯度:$\frac{53a}{50m}$×100%.
1.已知X、Y是主族元素,I为电离能,单位是kJ•mol-1.根据如表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是IIIA族元素 | |
| C. | 若元素Y处于第3周期,它的单质可与冷水剧烈反应 | |
| D. | 元素X与氯元素形成化合物时,化学式可能是XCl |
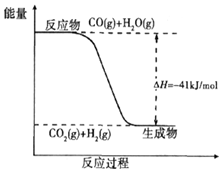
15. 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
a.此平衡体系,升温平衡向右移动.( A.向左、B.向右、C.不)
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
9.已知常温常压下,P2和P4燃烧的热化学方程式分别为:
2P2(g)+5O2(g)═P4O10(s)△H=-2 695.4kJ•mol-1,
P4(g)+5O2(g)═P4O10(s)△H=-2 925.1kJ•mol-1.则下列说法正确的是( )
2P2(g)+5O2(g)═P4O10(s)△H=-2 695.4kJ•mol-1,
P4(g)+5O2(g)═P4O10(s)△H=-2 925.1kJ•mol-1.则下列说法正确的是( )
| A. | 2P2(g)═P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时,P2比P4具有的能量高 |
 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.