题目内容
15. 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
b.对原平衡,在t0时升高温度对化学反应速率产生影响,在图中绘出速率变化图.
分析 a.由表中数据可知,升高温度,平衡常数增大,说明平衡正向移动;
b.升高温度,正逆反应速率都增大,平衡正向移动,正反应速率大于逆反应速率.
解答 解:a.由表中数据可知,升高温度,平衡常数增大,说明平衡正向移动,即向右移动,故答案为:向右;
b.升高温度,正逆反应速率都增大,平衡正向移动,正反应速率大于逆反应速率,图象为 ,
,
故答案为: ;
;
点评 本题主要考查温度对化学平衡的影响,为高频考点,注意把握表中数据的分析,难度不大,考查学生分析和解决问题的能力.

练习册系列答案
相关题目
5.电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=9.9×10-7mol/L.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=9.9×10-7mol/L.
3.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量CH3COONa固体,平衡向逆反应方向移动,c(CH3COO-)增大 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动,酸性增强 |
7.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目减少 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值不变 | D. | 溶液pH值增大 |
17.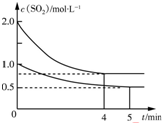 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )| A. | 放出的热量Q:Q(甲)>2Q(乙) | |
| B. | 体系总压强p:p(甲)>2p(乙) | |
| C. | 乙中前5 min内的反应速率v(O2)=0.05mol•L-1•min-1 | |
| D. | 保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)>v(逆) |