题目内容
17.工业制硝酸过程中的一个重要反应为4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.下列有关该反应的说法不正确的是( )| A. | O2是氧化剂 | B. | NH3是氧化剂 | C. | O2被还原 | D. | NH3发生氧化反应 |
分析 4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O中,N元素的化合价升高,O元素的化合价降低,以此来解答.
解答 解:A.O元素的化合价降低,O2是氧化剂,故A正确;
B.N元素的化合价升高,NH3是还原剂,故B错误;
C.O2得到电子被还原,故C正确;
D.N元素的化合价升高,则NH3发生氧化反应,故D正确;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.

练习册系列答案
相关题目
7.有机物HOOC-CH═CH-CH2-CH═C(CH3)-CH2OH,有关该物质可能具有的性质说法正确的是( )
| A. | 能发生取代、加成、氧化、加聚等反应 | |
| B. | 1mol该物质能和2molNaOH反应 | |
| C. | 1mol该物质与Br2等物质的量加成可得到三种产物 | |
| D. | 它与足量H2反应可得分子式为C8H18O3的物质 |
8.下列分子式表示的物质一定为纯净物的是( )
| A. | CH4O | B. | C2H6O | C. | C4H8 | D. | C5H12 |
5.电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=9.9×10-7mol/L.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)>c(CH3COO-)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=9.9×10-7mol/L.
12.下列说法中正确的是( )
| A. | 向0.1 mol•L-1氨水中加入少量水,pH减小,c(OH-)/c(NH3•H2O)减小 | |
| B. | 保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解 | |
| C. | FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体 | |
| D. | 将纯水加热的过程中,Kw变大,pH变小 |
2.下列叙述中错误的是( )
| A. | 在合成氨工业中,加压有利于提高NH3的产率 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效率好 | |
| C. | 化石燃料包括石油、天然气、煤和氢能 | |
| D. | 在时间允许的情况下,从节能上分析,步行>坐公交>坐出租车 |
7.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目减少 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值不变 | D. | 溶液pH值增大 |
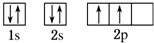 ,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.
,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.