题目内容
18.欲探究Cl2、Br2、I2的氧化性强弱,某同学设计了如图装置.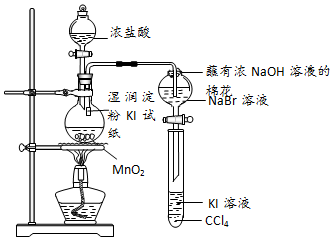
(1)写出MnO2与浓盐酸反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
(2)能说明Cl2氧化性强于I2的实验现象是淀粉KI变蓝色.
(3)蘸有浓NaOH溶液的棉花的作用是吸收实验过程中产生的Cl2气体
(4)有同学认为上述实验不能得出氧化性Cl2>Br2>I2的结论,理由是在探究氧化性Br2>I2时,无法排除Cl2对Br2与KI反应实验的干扰.
分析 二氧化锰和浓盐酸共热,反应制取氯气,氯气置换出碘化钠中的碘,变为单质,碘单质可以使KI的淀粉溶液变蓝;氯气氧化性强于溴,能够与溴化钾反应生成单质溴、单质溴与碘化钾反应,生成单质碘,碘被四氯化碳萃取在下层,氯气有毒,需要尾气吸收;用氢氧化钠吸收.
(1)MnO2与浓盐酸反应生成二氯化锰、氯气和水;
(2)氯气置换出碘化钠中的碘,变为单质,碘单质可以使KI的淀粉溶液变蓝;
(3)氯气、碘蒸气有毒,需要尾气吸收,蘸有浓NaOH溶液的棉花的吸收尾气;
(4)进入右边装置中的不但有溴蒸汽,还可能会有过量的氯气.
解答 解:(1)实验室制取氯气是二氧化锰和浓盐酸共热,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
(2)氯气通过湿润的淀粉KI试纸,淀粉变蓝色,是因为氯气与KI反应Cl2+2KI═2Cl-+I2,生成碘单质,碘遇淀粉变蓝色,
故答案为:蓝;
(3)氯气、碘蒸气能溶于氢氧化钠,Cl2+2NaOH=NaCl+NaClO+H20,I2+2NaOH=NaI+NaIO+H20,故蘸有浓NaOH溶液的棉花的作用是吸收尾气,
故答案为:Cl2;
(4)进入右边装置中的不但有溴蒸汽,还可能会有过量的氯气,即置换出碘的不一定是溴,还可能是氯气,故无法判断Br2的氧化性比I2强,
故答案为:在探究氧化性Br2>I2时,无法排除Cl2对Br2与KI反应实验的干扰.
点评 本题主要考查的是实验室制取氯气、氯气与溴和碘的氧化性比较等,掌握氯、溴、碘及其化合物的性质是解答关键,题目难度中等.

| A. | CH4O | B. | C2H6O | C. | C4H8 | D. | C5H12 |
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 乙烯和丙烯(CH2═CHCH3) | ||
| C. | 石墨和C60 | D. | CH3CHCH3CH3和CH3CH2CH2CH3 |
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量CH3COONa固体,平衡向逆反应方向移动,c(CH3COO-)增大 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动,酸性增强 |
| A. | 溶液中Ca2+数目减少 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值不变 | D. | 溶液pH值增大 |
| A. | Fe(OH)2 | B. | A l(OH)3 | C. | Fe(OH)3 | D. | Al(OH)3 和Fe(OH)3 |
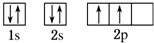 ,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.
,B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.