题目内容
9.已知常温常压下,P2和P4燃烧的热化学方程式分别为:2P2(g)+5O2(g)═P4O10(s)△H=-2 695.4kJ•mol-1,
P4(g)+5O2(g)═P4O10(s)△H=-2 925.1kJ•mol-1.则下列说法正确的是( )
| A. | 2P2(g)═P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时,P2比P4具有的能量高 |
分析 由①2P2(g)+5O2(g)═P4O10(s)△H=-2 695.4kJ•mol-1,
②P4(g)+5O2(g)═P4O10(s)△H=-2 925.1kJ•mol-1,
结合盖斯定律可知,①-②得到2P2(g)═P4(g)△H=+229.7 kJ•mol-1,可知P2能量低更稳定,以此来解答.
解答 解:A.由①2P2(g)+5O2(g)═P4O10(s)△H=-2 695.4kJ•mol-1,
②P4(g)+5O2(g)═P4O10(s)△H=-2 925.1kJ•mol-1,
结合盖斯定律可知,①-②得到2P2(g)═P4(g)△H=+229.7 kJ•mol-1,故A错误;
B.P2制P4是吸热反应,故B错误;
C.P2能量低更稳定,故C正确;
D.等质量时,P2比P4具有的能量低,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握盖斯定律的应用、稳定性与能量的关系为解答的关键,侧重分析与应用能力的考查,注意选项A中的焓变,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目减少 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值不变 | D. | 溶液pH值增大 |
17.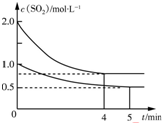 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197.74kJ•mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol•L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )| A. | 放出的热量Q:Q(甲)>2Q(乙) | |
| B. | 体系总压强p:p(甲)>2p(乙) | |
| C. | 乙中前5 min内的反应速率v(O2)=0.05mol•L-1•min-1 | |
| D. | 保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)>v(逆) |
14.有一种烃,其结构简式可以表示为:
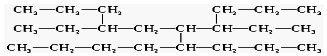
命名该有机物时,应认定它的主链上的碳原子数目是( )

命名该有机物时,应认定它的主链上的碳原子数目是( )
| A. | 8 | B. | 9 | C. | 11 | D. | 12 |
1.将少量铝铁合金投入盐酸溶液中,完全溶解后,再加入过量的氢氧化钠溶液,最终生成的沉淀是( )
| A. | Fe(OH)2 | B. | A l(OH)3 | C. | Fe(OH)3 | D. | Al(OH)3 和Fe(OH)3 |