题目内容
11. 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.(1)用煤可以制得水煤气.工业上可用煤和水通过水煤气法制氢气,已知下列热化学方程式:
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.5kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1
试求水煤气法制氢气的反应的反应热△H3.
C(s)+H2O(g)═CO(g)+H2(g)△H3=+131.3kJ•mol-1
(2)若H-H、O=O和O-H键的键能分别是436kJ•mol-1、496kJ•mol-1和m kJ•mol-1,结合上述热化学方程式的相关数据计算,m=462.9.
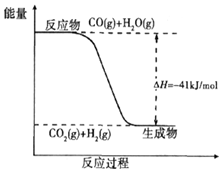
(3)已知一氧化碳与水蒸气反应过程的能量变化如图所示:则此反应为放热(填“吸热”或“放热”)反应,反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol.
分析 (1)依据热化学方程式 和盖斯定律计算得到;
(2)根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=H产物-H反应物再结合化学键能和物质能量的关系来回答;
(3)依据图象分析反应物能量高于生成物能量,反应是放热反应,依据反应的热化学方程式标注物质聚集状态和对应焓变的大小.
解答 解:(1)①C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ/mol
②2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ/mol
依据盖斯定律①-$\frac{②}{2}$得到:C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3KJ/mol;
故答案为:+131.3;
(2)已知①:C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3KJ/mol,
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.5kJ•mol-1
①×2-②×2得:2H2O(g)═O2(g)+2H2(g)△H=(2×131.3KJ+221)kJ•mol-1,
4×m-496-2×436=2×131.3KJ+221,
解得m=+462.9,故答案为:462.9;
(3)图象分析判断反应物能量高于生成物能量,反应是放热反应,1molCO完全反应放出的热量41KJ,热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;
故答案为:放热;CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol.
点评 本题考查热化学方程式的书写和盖斯定律应用,图象分析理解是关键,题目较简单.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
2.下列叙述中错误的是( )
| A. | 在合成氨工业中,加压有利于提高NH3的产率 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效率好 | |
| C. | 化石燃料包括石油、天然气、煤和氢能 | |
| D. | 在时间允许的情况下,从节能上分析,步行>坐公交>坐出租车 |
19.以下列出的是一些基态原子的2p轨道和3d轨道中电子排布的情况,违反洪特规则的有( )
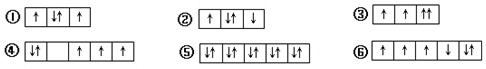

| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ③④⑥ |
3.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量CH3COONa固体,平衡向逆反应方向移动,c(CH3COO-)增大 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动,酸性增强 |
14.有一种烃,其结构简式可以表示为:
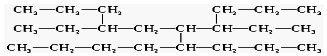
命名该有机物时,应认定它的主链上的碳原子数目是( )

命名该有机物时,应认定它的主链上的碳原子数目是( )
| A. | 8 | B. | 9 | C. | 11 | D. | 12 |
