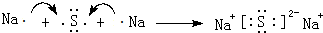题目内容
11.浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气.| 序号 | ① | ② | ③ | ④ |
| 仪器装置 | 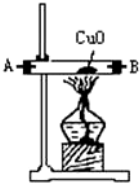 | 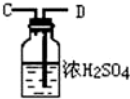 | 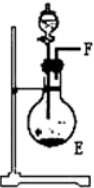 |  |
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C…)F→G→H→A→B→D→C(A、B顺序可颠倒).
(2)E中发生反应的化学方程式是CaO+NH3•H2O=Ca(OH)2+NH3↑.
(3)装置④中应当选用的干燥剂是(写名称)碱石灰.
(4)装置①中发生氧化还原反应的化学方程式是2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑3H2O+3Cu.其中氧化剂是CuO,氧化产物是N2(写化学式).
(5)装置②中浓硫酸的作用是除去水蒸气和氨气.
分析 (1)依据题意可知,装置连接顺序为:氨气制备装置、干燥装置、氮气制备装置、尾气吸收装置;
(2)氧化钙与氨水反应生成氢氧化钙和氨气;
(3)氨气为碱性气体,应选择碱性干燥剂;
(4)氨气与氧化铜发生氧化还原反应生成氮气和铜、水;依据方程式中元素化合价变化判断氧化剂、氧化产物;
(5)浓硫酸具有吸水性和酸性,可以吸收水蒸气和氨气.
解答 解:(1)依据题意可知,装置连接顺序为:氨气制备装置、干燥装置、氮气制备装置、尾气吸收装置,浓氨水可与新制生石灰作用生成氨气,反应不需要加热所以选择③为氨气发生装置,制取的氨气含有水蒸气,应通过④进行干燥,干燥的氨气与氧化铜在①中发生氧化还原反应生成氮气,剩余氨气用盛有浓硫酸的装置②吸收,所以正确的顺序为:F→G→H→A→B→D→C(A、B顺序可颠倒);
故答案为:F→G→H→A→B→D→C(A、B顺序可颠倒);
(2)氧化钙与氨水反应生成氢氧化钙和氨气,化学方程式:CaO+NH3•H2O=Ca(OH)2+NH 3↑;
故答案为:CaO+NH3•H2O=Ca(OH)2+NH 3↑;
(3)氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气;
故答案为:碱石灰;
(4)氨气与氧化铜发生氧化还原反应生成氮气和铜、水,化学方程式:2NH 3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N 2↑3H 2O+3Cu;反应中氧化铜中+2价铜化合价降低,所以氧化铜为氧化剂,氨气中-3价氮化合价升高为氮气中0价,所以氮气为氧化产物;
故答案为:2NH 3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N 2↑3H 2O+3Cu;CuO;N2;
(5)浓硫酸具有吸水性和酸性,可以吸收水蒸气和氨气;
故答案为:除去水蒸气和氨气.
点评 本题考查了氨气的制备和性质检验,明确氨气制备原理及性质是解题关键,注意实验各实验装置的作用,题目难度不大.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| 元素代号 | A | B | D | E | F | G | I | J |
| 化合价 | +1 | -2 | +5、-3 | +4、-4 | +7、-1 | +3 | +2 | +1 |
| 原子半/nm | 0.037 | 0.074 | 0.075 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A、B组成的化合物与A、E组成的化合物中均可能含有非极性共价键 | |
| B. | 离子半径由大到小顺序是F>D>B>J>G | |
| C. | B、J组成的化合物一定属于离子化合物,它与水的反应可能是氧化还原反应 | |
| D. | 工业上生产G、I、J的单质均是通过电解它们的熔融氯化物实现的 |
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
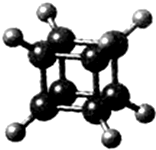
| A. | 它在核磁共振氢谱中只出现一个峰 | |
| B. | 它二氯代物有三种同分异构体 | |
| C. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 | |
| D. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.02 | 20.00 | 18.80 | 19.98 |
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大.
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案用pH计(或精密pH试纸)测定相同浓度的醋酸在几种不同温度时的pH.
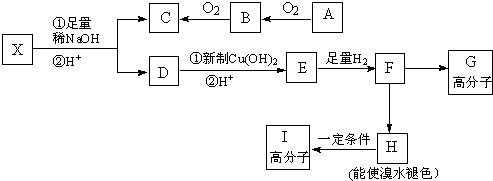
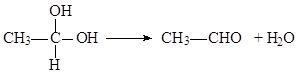
 .
.