题目内容
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )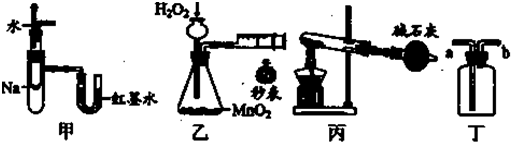

| A、装置甲可用于验证反应的热效应 |
| B、装置乙可定量测定化学反应的速率 |
| C、装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D、装置丁a口进气可收集NH3、C12等气体 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.利用气体的热胀冷缩的原理解答;
B.长颈漏斗,不能防止气体逸出;
C.加热NH4Cl生成的NH3和HCl会在试管口重新冷凝;
D.氨气的密度比空气小.
B.长颈漏斗,不能防止气体逸出;
C.加热NH4Cl生成的NH3和HCl会在试管口重新冷凝;
D.氨气的密度比空气小.
解答:
解:A.第一个装置左边为大试管中套有小试管,且大试管和小试管间密封,右边U形管用红墨水液封,即大试管和小试管U形管间和密封了一段空气,钠与水反应放热,密封的一段空气温度升高,体积膨胀,U形管中红墨水,左边液面降低,右边液面升高,能验证反应的热效应,故A正确;
B.定量测定化学反应速率,第二个装置,用长颈漏斗加过氧化氢,虽然过氧化氢在二氧化锰的作用下能生成氧气,但长颈漏斗不能防止生成的氢气从长颈漏斗中逸出,所以右边的针筒中活塞不移动,故不能达到定量测定化学反应速率实验目的,故B错误;
C.加热NH4Cl生成的NH3和HCl会在试管口重新冷凝,NH3不会逸出干燥管,故C错误;
D.a口进气可取得CO2、Cl2等密度比空气大的气体;氨气的密度比空气小,应从b口进,故D错误.
故选A.
B.定量测定化学反应速率,第二个装置,用长颈漏斗加过氧化氢,虽然过氧化氢在二氧化锰的作用下能生成氧气,但长颈漏斗不能防止生成的氢气从长颈漏斗中逸出,所以右边的针筒中活塞不移动,故不能达到定量测定化学反应速率实验目的,故B错误;
C.加热NH4Cl生成的NH3和HCl会在试管口重新冷凝,NH3不会逸出干燥管,故C错误;
D.a口进气可取得CO2、Cl2等密度比空气大的气体;氨气的密度比空气小,应从b口进,故D错误.
故选A.
点评:本题考查化学实验方案的评价,为高频考点,涉及反应热、化学反应速率、物质制备及气体收集等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
已知N2+O2═2NO为吸热反应,△H=+180kJ?mol-1,其中N≡N、O═O键的键能分别为946kJ?mol-1、498kJ?mol-1,则N-O键的键能为( )
| A、1 264kJ?mol-1 |
| B、632kJ?mol-1 |
| C、316kJ?mol-1 |
| D、1 624kJ?mol-1 |
 如图是元素周期表短周期的一部分,已知B原子与C原子核外电子总数和为A原子核外电子总数的4倍,则以下推断正确的是( )
如图是元素周期表短周期的一部分,已知B原子与C原子核外电子总数和为A原子核外电子总数的4倍,则以下推断正确的是( )| A、三者皆为非金属元素 |
| B、B与A、B与C均可以形成离子化合物 |
| C、三者核电荷数之和为40 |
| D、B与C只能形成一种共价化合物 |
标准状况下有①0.112L水;②3.01×1023个氯化氢分子;③13.6g H2S气体;④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
| A、体积:①③②④ |
| B、密度:④①③② |
| C、质量:①④③② |
| D、氢原子数:②④③① |
下列关于钠及其化合物的说法不正确的是( )
| A、Na-K合金常温下呈液态,可做核反应堆的导热剂 |
| B、Na2O和Na2O2其阴阳离子个数比相等,Na2O在空气中加热会变成淡黄色的Na2O2 |
| C、Na2CO3和NaHCO3的水溶液均显碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,其PH前者大 |
| D、Na2CO3和NaHCO3两固体可用加热法鉴别,Na2CO3和NaHCO3两溶液可滴加Ba(OH)2溶液来鉴别 |
设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| B、1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| C、常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,下列做法不正确的是( )
| A、研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、铁强化酱油可通过膳食补充人体所需的铁元素 |
| D、地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同 |
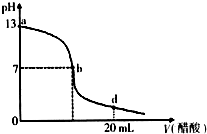 向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )
向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )| A、该NaOH溶液的物质的量浓度为0.1 mol/L |
| B、在b点,c (Na+)=c(CH3COO-) |
| C、该NaOH溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
| D、在d点,溶液中所有离子浓度由大到小的顺序为c (CH3COO-)>c (Na+)>c (H+)>c (OH-) |
下列比较正确的是( )
| A、密度:K>Na |
| B、离子半径:H->Li+ |
| C、碱性:LiOH>NaOH |
| D、熔沸点:Rb>K |