题目内容
已知N2+O2═2NO为吸热反应,△H=+180kJ?mol-1,其中N≡N、O═O键的键能分别为946kJ?mol-1、498kJ?mol-1,则N-O键的键能为( )
| A、1 264kJ?mol-1 |
| B、632kJ?mol-1 |
| C、316kJ?mol-1 |
| D、1 624kJ?mol-1 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,1molN2含有1molN≡N,1molO2含有1molO═O,1molNO含有1molN-O,依据△H=反应物的总键能-生成物的总键能计算.
解答:
解:根据N2、O2分子中化学键的键能分别是946kJ?mol-1、498kJ?mol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1,可设NO分子中化学键的键能为X,则有:△H=反应物的总键能-生成物的总键能=946kJ?mol-1+498kJ?mol-1-2X=+180kJ?mol-1,得:X=632kJ?mol-1,则N-O键的键能为632kJ?mol-1,
故选B.
故选B.
点评:本题主要考查了键能与反应热的关系,注意旧键断裂吸收的能量减去新键生成释放的能量值即为反应热为解答关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某同学写出的下列烷烃的名称中,不正确的是( )
| A、3-甲基-2-乙基戊烷 |
| B、3,3-二甲基己烷 |
| C、2,3-二甲基丁烷 |
| D、2,2,3,3-四甲基丁烷 |
下列关于热化学反应的描述中正确的是( )
| A、CO燃烧是吸热反应 |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol |
| D、1mol CH4燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
下列有关物质分离的实验:①用渗析法分离蛋白质和葡萄糖的混合液 ②用盐析法分离油脂皂化反应的产物 ③用升华法分离碘和砂子的混合物 ④用分液法分离已烷和水的混合物 ⑤用结晶法分离硝酸钾和氯化钠的混合物 ⑥用蒸馏法分离酒精与苯酚钠的混合物.你认为( )
| A、只有①不正确 |
| B、②④⑥不正确 |
| C、只有③⑤⑥正确 |
| D、全部正确 |
下列关于电离度的叙述正确的是( )
| A、电离度可以表示弱电解质的相对强弱,它是已电离的电解质浓度占未电离分子浓度的百分比 |
| B、对同一弱电解质一般是浓度越小,温度越高,电离度越大 |
| C、pH=3的一元酸HA酸溶液稀释100倍后pH=5 |
| D、弱电解质的电离度随溶液的稀释而增大,溶液的导电性不断增强 |
下列说法正确的是( )
| A、实验中为了得到纯净的晶体,制得的硫酸亚铁铵和阿司匹林晶体均用酒精洗涤 |
| B、在原电池实验中,加入重铬酸钾溶液或6%H2O2溶液的目的是降低电极的极化作用 |
| C、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,会使溶液的红色加深 |
| D、在用标准NaOH溶液滴定食醋的实验中,滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏低 |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为1NA |
| B、常温常压下,106gNa2CO3含有的Na+离子数为2NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol?/L的MgCl2溶液中,含有Cl-个数为1NA |
下列装置或操作错误,不能达到实验目的是( )
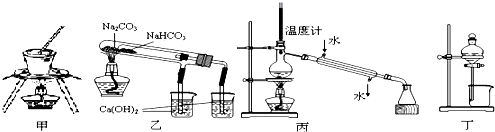

| A、用甲图装置可用于加热、灼烧固体 |
| B、用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
| C、用丙图装置分离乙醇与水 |
| D、用丁图装置可由四氯化碳萃取碘水中的碘 |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )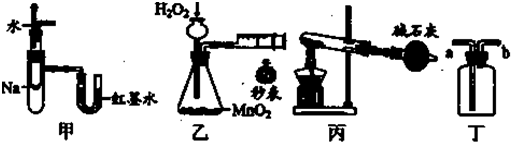

| A、装置甲可用于验证反应的热效应 |
| B、装置乙可定量测定化学反应的速率 |
| C、装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D、装置丁a口进气可收集NH3、C12等气体 |