题目内容
标准状况下有①0.112L水;②3.01×1023个氯化氢分子;③13.6g H2S气体;④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
| A、体积:①③②④ |
| B、密度:④①③② |
| C、质量:①④③② |
| D、氢原子数:②④③① |
考点:阿伏加德罗定律及推论
专题:计算题,阿伏加德罗常数和阿伏加德罗定律
分析:标况下,水是液体,气体摩尔体积对其不适用,n(HCl)=
=0.5mol、n(H2S)=
=0.4mol、n(NH3)=0.2mol,根据V=nVm、ρ=
、m=nM、N=nNA再结合物质状态分析解答.
| 3.01×1023 |
| 6.02×1023/mol |
| 13.6g |
| 34g/mol |
| M |
| Vm |
解答:
解:标况下,水是液体,气体摩尔体积对其不适用,n(HCl)=
=0.5mol、n(H2S)=
=0.4mol、n(NH3)=0.2mol,
A.水的体积是0.112L,V(HCl)=0.5mol×22.4L/mol=11.2L、V(H2S)=0.4mol×22.4L/mol=8.96L、V(NH3)=0.2mol×22.4L/mol=4.48L,所以由小到大排列正确的是①④③②,故A错误;
B.水的密度是1g/mL,根据ρ=
知,气体密度与其摩尔质量成正比,HCl的摩尔质量是36.5g/mol、硫化氢摩尔质量是34g/mol、氨气摩尔质量是17g/mol,气体密度都小于1g/mL,所以密度从小到大顺序是④③②①,故B错误;
C.水的质量是112g,m(HCl)=0.5mol×36.5g/mol=18.25g、m(H2S)=0.4mol×34g/mol=13.6g、m(NH3)=0.2mol×17g/mol=3.4g,所以质量从小到大顺序是④③②①,故C错误;
D.水中N(H)=
×NA/mol×2=12.4NA,HCl中N(H)=0.5mol×NA/mol×1=0.5NA,硫化氢中N(H)=0.4mol×NA/mol×2=0.8NA,氨气中N(H)=0.2×NA/mol×3=0.6NA,所以H原子个数由小到大顺序是②④③①,故D正确.
故选D.
| 3.01×1023 |
| 6.02×1023/mol |
| 13.6g |
| 34g/mol |
A.水的体积是0.112L,V(HCl)=0.5mol×22.4L/mol=11.2L、V(H2S)=0.4mol×22.4L/mol=8.96L、V(NH3)=0.2mol×22.4L/mol=4.48L,所以由小到大排列正确的是①④③②,故A错误;
B.水的密度是1g/mL,根据ρ=
| M |
| Vm |
C.水的质量是112g,m(HCl)=0.5mol×36.5g/mol=18.25g、m(H2S)=0.4mol×34g/mol=13.6g、m(NH3)=0.2mol×17g/mol=3.4g,所以质量从小到大顺序是④③②①,故C错误;
D.水中N(H)=
| 112g |
| 18g/mol |
故选D.
点评:本题考查了阿伏伽德罗定律及其推论,明确各个物理量之间的关系是解本题关键,灵活运用公式即可解答,注意气体摩尔体积的适用范围,水的有关计算为易错点.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
下列有关物质分离的实验:①用渗析法分离蛋白质和葡萄糖的混合液 ②用盐析法分离油脂皂化反应的产物 ③用升华法分离碘和砂子的混合物 ④用分液法分离已烷和水的混合物 ⑤用结晶法分离硝酸钾和氯化钠的混合物 ⑥用蒸馏法分离酒精与苯酚钠的混合物.你认为( )
| A、只有①不正确 |
| B、②④⑥不正确 |
| C、只有③⑤⑥正确 |
| D、全部正确 |
下列装置或操作错误,不能达到实验目的是( )
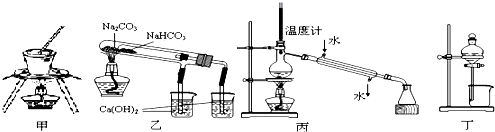

| A、用甲图装置可用于加热、灼烧固体 |
| B、用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
| C、用丙图装置分离乙醇与水 |
| D、用丁图装置可由四氯化碳萃取碘水中的碘 |
气态反应A(g)+3B(g)═2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是( )
| A、vA=0.15 mol/(L?min) |
| B、vB=0.6 mol/(L?min) |
| C、vC=0.4 mol/(L?min) |
| D、vD=0.6 mol/(L?min) |
在0.1mol/L的氨水中存在 NH3?H2O?NH4++OH-的电离平衡,下列措施都能使 该平衡向右移动的一组是( )
①加入少量HCl;②加入固体NaOH;③加水;④通入氨气;⑤加热升高温度;⑥加入NH4NO3.
①加入少量HCl;②加入固体NaOH;③加水;④通入氨气;⑤加热升高温度;⑥加入NH4NO3.
| A、①③④⑤ | B、①③④⑤⑥ |
| C、②③④⑤ | D、①③④⑥ |
 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 |
| B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,且Mg2+和Fe3+至少存在一种 |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )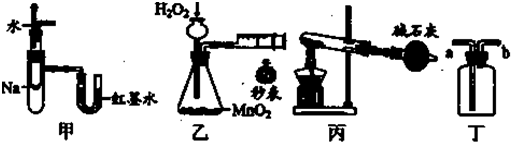

| A、装置甲可用于验证反应的热效应 |
| B、装置乙可定量测定化学反应的速率 |
| C、装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D、装置丁a口进气可收集NH3、C12等气体 |
下列装置或操作能达到实验目的是( )
A、 量取8.5mL稀硫酸 |
B、 制备FeNaOH溶液 |
C、 防止铁钉生锈 |
D、 用酒精萃取水中的溴 |
在硫酸、明矾和硫酸钾组成的混合溶液中,c(Al3+)=0.4mol?L-1、c(SO42-)=0.8mol?L-1、水电离的
c(H+)=10-13 mol?L-1、则c(K+)为( )
c(H+)=10-13 mol?L-1、则c(K+)为( )
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |