题目内容
设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| B、1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| C、常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.一氧化氮与氧气反应生成二氧化氮,导致混合气体的分子数减少;
B.羟基中含有9个电子,氢氧根离子含有10个电子;
C.烯烃中极性键为碳氢键,乙烯和丁烯的最简式为CH2,根据最简式计算出混合物中含有碳氢键数目;
D.二氧化硫与氧气生成三氧化硫的反应为可逆反应,反应物不可能完全转化成生成物.
B.羟基中含有9个电子,氢氧根离子含有10个电子;
C.烯烃中极性键为碳氢键,乙烯和丁烯的最简式为CH2,根据最简式计算出混合物中含有碳氢键数目;
D.二氧化硫与氧气生成三氧化硫的反应为可逆反应,反应物不可能完全转化成生成物.
解答:
解:A.标准状况下,11.2L混合气体的物质的量为0.5mol,由于O2和NO反应生成二氧化氮,导致气体分子数减少,混合物含有的分子数小于0.5×6.02×1023,故A错误;
B.1mol的羟基中含有9mol电子,1 mol的氢氧根离子含有10mol电子,所含电子数不同,故B错误;
C.42g乙烯和丁烯的混合物中含有3mol最简式CH2,含有6mol氢原子,烯烃中极性键为碳氢键,6mol氢原子形成了6mol碳氢极性键,所以混合气体中含有极性键数为6NA,故C正确;
D.6.4g二氧化硫的物质的量为0.1mol,0.1mol二氧化硫与氧气反应,由于该反应为可逆反应,则反应生成的三氧化硫小于0.1mol,转移的电子小于0.2mol,转移电子数为0.2NA,故D错误;
故选C.
B.1mol的羟基中含有9mol电子,1 mol的氢氧根离子含有10mol电子,所含电子数不同,故B错误;
C.42g乙烯和丁烯的混合物中含有3mol最简式CH2,含有6mol氢原子,烯烃中极性键为碳氢键,6mol氢原子形成了6mol碳氢极性键,所以混合气体中含有极性键数为6NA,故C正确;
D.6.4g二氧化硫的物质的量为0.1mol,0.1mol二氧化硫与氧气反应,由于该反应为可逆反应,则反应生成的三氧化硫小于0.1mol,转移的电子小于0.2mol,转移电子数为0.2NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确可逆反应特点,选项B为易错点,注意羟基与氢氧根离子的区别.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列说法正确的是( )
| A、实验中为了得到纯净的晶体,制得的硫酸亚铁铵和阿司匹林晶体均用酒精洗涤 |
| B、在原电池实验中,加入重铬酸钾溶液或6%H2O2溶液的目的是降低电极的极化作用 |
| C、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,会使溶液的红色加深 |
| D、在用标准NaOH溶液滴定食醋的实验中,滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏低 |
气态反应A(g)+3B(g)═2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是( )
| A、vA=0.15 mol/(L?min) |
| B、vB=0.6 mol/(L?min) |
| C、vC=0.4 mol/(L?min) |
| D、vD=0.6 mol/(L?min) |
 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质只有Na2SO4 |
| B、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,且Mg2+和Fe3+至少存在一种 |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )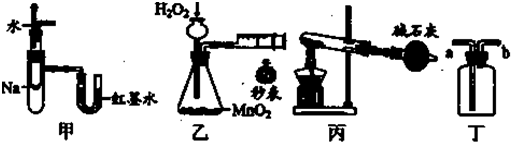

| A、装置甲可用于验证反应的热效应 |
| B、装置乙可定量测定化学反应的速率 |
| C、装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D、装置丁a口进气可收集NH3、C12等气体 |
下列关于0.1mol/L硝酸钾溶液配制的说法中,错误的是( )
| A、0.05molKNO3溶于水配制成500mL水溶液 |
| B、0.01molKNO3溶于100mL水配制而成 |
| C、0.2mol/LKNO3溶液100mL稀释成200mL |
| D、0.1molKNO3溶于水配制成1L水溶液 |
下列装置或操作能达到实验目的是( )
A、 量取8.5mL稀硫酸 |
B、 制备FeNaOH溶液 |
C、 防止铁钉生锈 |
D、 用酒精萃取水中的溴 |
CH3C(C2H5)2CH(CH3)2的名称是( )
| A、1,3-二甲基戊烷 |
| B、2-甲基-3,3-二乙基丁烷 |
| C、3,4-二甲基戊烷 |
| D、2,3-二甲基-3-乙基戊烷 |
化学实验中的安全意识是重要的科学素养.下列对实验中出现的事故处理方法正确的是( )
| A、皮肤上沾上浓硫酸应立即用氢氧化钠溶液中和 |
| B、酒精灯中酒精不慎洒出在桌上燃烧,应立即用湿布扑盖 |
| C、氢氧化钠溶液溅到眼睛中,立即闭上眼睛,轻轻揉搓 |
| D、实验中出现轻微气体中毒,受伤人员应立即伏到实验桌上好好休息 |