题目内容
下列关于钠及其化合物的说法不正确的是( )
| A、Na-K合金常温下呈液态,可做核反应堆的导热剂 |
| B、Na2O和Na2O2其阴阳离子个数比相等,Na2O在空气中加热会变成淡黄色的Na2O2 |
| C、Na2CO3和NaHCO3的水溶液均显碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,其PH前者大 |
| D、Na2CO3和NaHCO3两固体可用加热法鉴别,Na2CO3和NaHCO3两溶液可滴加Ba(OH)2溶液来鉴别 |
考点:钠的化学性质,钠的重要化合物
专题:金属概论与碱元素
分析:A、根据钠钾合金熔点低,可作原子反应堆的导热剂;
B、Na2O和Na2O2其阴阳离子个数比均为1:2,2Na2O+O2
2Na2O2;
C、Na2CO3和NaHCO3因水解使溶液呈碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,Na2CO3水解程度大,溶液碱性强;
D、Na2CO3和NaHCO3两溶液分别滴加Ba(OH)2溶液,均会产生沉淀.
B、Na2O和Na2O2其阴阳离子个数比均为1:2,2Na2O+O2
| ||
C、Na2CO3和NaHCO3因水解使溶液呈碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,Na2CO3水解程度大,溶液碱性强;
D、Na2CO3和NaHCO3两溶液分别滴加Ba(OH)2溶液,均会产生沉淀.
解答:
解:A、钠钾合金熔点低,通常状况下呈液态,可作原子反应堆的导热剂,故A正确;
B、Na2O和Na2O2其阴阳离子个数比均为1:2,2Na2O+O2
2Na2O2,过氧化钠为淡黄色固体,故B正确;
C、Na2CO3和NaHCO3因水解使溶液呈碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,Na2CO3水解程度大,溶液碱性强,PH大,故C正确;
D、碳酸氢钠受热易分解,碳酸钠热稳定性强,用加热法鉴别,Na2CO3和NaHCO3两溶液分别滴加Ba(OH)2溶液,均会产生沉淀,因此不能用Ba(OH)2溶液来鉴别,故D错误;
故选D.
B、Na2O和Na2O2其阴阳离子个数比均为1:2,2Na2O+O2
| ||
C、Na2CO3和NaHCO3因水解使溶液呈碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,Na2CO3水解程度大,溶液碱性强,PH大,故C正确;
D、碳酸氢钠受热易分解,碳酸钠热稳定性强,用加热法鉴别,Na2CO3和NaHCO3两溶液分别滴加Ba(OH)2溶液,均会产生沉淀,因此不能用Ba(OH)2溶液来鉴别,故D错误;
故选D.
点评:本题考查了金属钠及其重要化合物的性质,题目难度一般,侧重于过氧化钠阴阳离子比、盐类的水解、物质的鉴别,掌握元素及其化合物的性质是解题的根本.

练习册系列答案
相关题目
下列关于电离度的叙述正确的是( )
| A、电离度可以表示弱电解质的相对强弱,它是已电离的电解质浓度占未电离分子浓度的百分比 |
| B、对同一弱电解质一般是浓度越小,温度越高,电离度越大 |
| C、pH=3的一元酸HA酸溶液稀释100倍后pH=5 |
| D、弱电解质的电离度随溶液的稀释而增大,溶液的导电性不断增强 |
下列说法中不正确的是( )
| A、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
B、结构简式为 的有机物其名称为 2-丁醇 的有机物其名称为 2-丁醇 |
| C、分子式为C4H8Br2结构中含一个一CH3的同分异构体(不考虑立体异构)有4种 |
D、某有机物球棍结构模型为: ,则该有机物能发生消去反应和氧化反应 ,则该有机物能发生消去反应和氧化反应 |
在0.1mol/L的氨水中存在 NH3?H2O?NH4++OH-的电离平衡,下列措施都能使 该平衡向右移动的一组是( )
①加入少量HCl;②加入固体NaOH;③加水;④通入氨气;⑤加热升高温度;⑥加入NH4NO3.
①加入少量HCl;②加入固体NaOH;③加水;④通入氨气;⑤加热升高温度;⑥加入NH4NO3.
| A、①③④⑤ | B、①③④⑤⑥ |
| C、②③④⑤ | D、①③④⑥ |
下列既有氧化性又有还原性的微粒是( )
| A、I- |
| B、N203 |
| C、Fe3+ |
| D、SiO2 |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )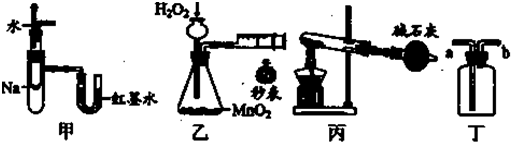

| A、装置甲可用于验证反应的热效应 |
| B、装置乙可定量测定化学反应的速率 |
| C、装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D、装置丁a口进气可收集NH3、C12等气体 |
下列实验式中,没有相对分子质量就可以确定分子式的是( )
①CH3 ②CH ③CH2 ④C2H5 ⑤CH2Cl2.
①CH3 ②CH ③CH2 ④C2H5 ⑤CH2Cl2.
| A、①② | B、③④⑤ |
| C、①④⑤ | D、①③④ |
一定温度下,反应:N2(g)+3H2(g)?2NH3(g),达到化学平衡状态的标志是( )
| A、c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2 |
| B、N2,H2和NH3的质量分数不再改变 |
| C、气体压强的压强不再改变 |
| D、单位时间内每增加1 mol N2,同时增加3 mol H2 |
下列实验操作或对实验事实的描述正确的是 ( )
| A、不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| B、定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |
| C、使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大 |
| D、用铝箔包住部分被氧化成Na2O的钠块,并用镊子夹住在水槽中反应,用倒置的量筒量取生成气体的体积,可以计算钠块中钠单质的质量分数 |
| E、用托盘天平称量11.74g氯化钠晶体 |
| F、为了使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜网包裹的锌粒 |