题目内容
下列比较正确的是( )
| A、密度:K>Na |
| B、离子半径:H->Li+ |
| C、碱性:LiOH>NaOH |
| D、熔沸点:Rb>K |
考点:碱金属的性质
专题:元素周期律与元素周期表专题
分析:A.依据钠与钾的密度大小解答;
B.具有相同核外电子排布的,原子序数越大,微粒半径越小;
C.依据同主族元素金属性从上到下依次增强解答;
D.依据同主族元素熔沸点的递变规律解答.
B.具有相同核外电子排布的,原子序数越大,微粒半径越小;
C.依据同主族元素金属性从上到下依次增强解答;
D.依据同主族元素熔沸点的递变规律解答.
解答:
解:A.钠的密度大于钾,故A错误;
B.H-和Li+具有相同的核外电子排布,H原子序数小于Li,所以离子半径H->Li+,故B正确;
C.Li与Na位于同主族,钠位于锂的下方,所以金属性,钠强于锂,金属性越强,最高价氧化物对应水化物碱性越强,所以碱性:LiOH<NaOH,故C错误;
D.Rb和K位于同主族,Rb位于K的下方,从上到下单质的熔沸点依次降低,故D错误;
故选:B.
B.H-和Li+具有相同的核外电子排布,H原子序数小于Li,所以离子半径H->Li+,故B正确;
C.Li与Na位于同主族,钠位于锂的下方,所以金属性,钠强于锂,金属性越强,最高价氧化物对应水化物碱性越强,所以碱性:LiOH<NaOH,故C错误;
D.Rb和K位于同主族,Rb位于K的下方,从上到下单质的熔沸点依次降低,故D错误;
故选:B.
点评:本题考查了碱金属元素的性质,题目难度不大,熟悉同主族元素性质的递变规律是解题关键,注意钾的密度的特殊性.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )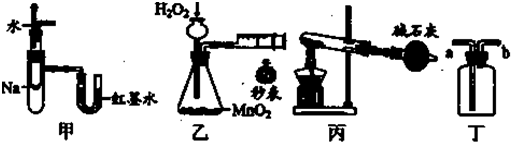

| A、装置甲可用于验证反应的热效应 |
| B、装置乙可定量测定化学反应的速率 |
| C、装置丙可用于实验室以NH4Cl为原料制备少量NH3 |
| D、装置丁a口进气可收集NH3、C12等气体 |
下列物质:①Hg(NO3)2 ②HCHO(甲醛) ③MgSO4 ④NH4Cl ⑤KOH中,能使蛋白质变性的是( )
| A、②③④ | B、①③⑤ |
| C、①②③ | D、①②⑤ |
在硫酸、明矾和硫酸钾组成的混合溶液中,c(Al3+)=0.4mol?L-1、c(SO42-)=0.8mol?L-1、水电离的
c(H+)=10-13 mol?L-1、则c(K+)为( )
c(H+)=10-13 mol?L-1、则c(K+)为( )
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
下列实验操作或对实验事实的描述正确的是 ( )
| A、不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| B、定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |
| C、使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大 |
| D、用铝箔包住部分被氧化成Na2O的钠块,并用镊子夹住在水槽中反应,用倒置的量筒量取生成气体的体积,可以计算钠块中钠单质的质量分数 |
| E、用托盘天平称量11.74g氯化钠晶体 |
| F、为了使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜网包裹的锌粒 |
化学实验中的安全意识是重要的科学素养.下列对实验中出现的事故处理方法正确的是( )
| A、皮肤上沾上浓硫酸应立即用氢氧化钠溶液中和 |
| B、酒精灯中酒精不慎洒出在桌上燃烧,应立即用湿布扑盖 |
| C、氢氧化钠溶液溅到眼睛中,立即闭上眼睛,轻轻揉搓 |
| D、实验中出现轻微气体中毒,受伤人员应立即伏到实验桌上好好休息 |
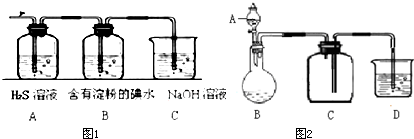


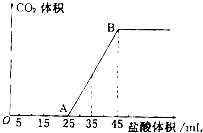 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题