题目内容
8.高铁酸钾(K2FeO4)在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2.图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况.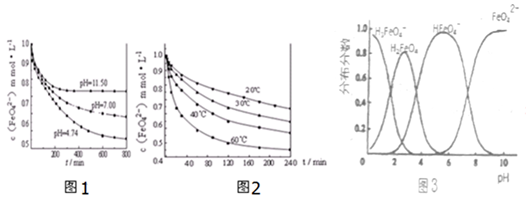
①pH=4.74时,反应从开始到800min时平均反应速率v(OH-)=0.001375mol•L-1•min-1.
②图1在800min后,三种溶液中的c(FeO42-)均不再改变.随着pH的变大,此反应的平衡常数K不变(填“变大”、“变小”或“不变”).
③图2在240min后,四种溶液中FeO42-的浓度不再变化,下列说法正确的是ad
a.上述反应的△H>0 b.升高温度,该反应pH减小
c.温度越高,反应速率越慢 d.加入盐酸,FeO42-的浓度减小
④FeO42-在水溶液中的存在形态如图3所示.下列说法正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐变大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
已知:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是杀菌消毒、吸附悬浮物.
分析 ①分析图象计算FeO42-离子的变化浓度,结合化学反应速率概念及反应速率之比等于系数之比计算得到;
②平衡常数仅随温度变化,不随溶液酸碱性,离子浓度变化;
③a.图象分析可知温度升高,消耗的FeO42-浓度增大,平衡正向进行;
b.升高温度,消耗的FeO42-浓度增大,平衡正向进行,生成氢氧根增多;
c.温度越高,反应速率越块;
d.加入盐酸,消耗氢氧根离子,平衡正向移动;
④根据图象的内容来分析图象所描述的意义;
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,还原产物能形成胶体具有吸附悬浮杂质的作用.
解答 解:①由图象分析可知pH=4.74时,反应从开 始到800min,消耗FeO42-离子浓度为1.0mol/L-0.45mol/L=0.55mol/L,根据反应速率之比等于系数之比,则平均反应速率v(OH-)=2v(FeO42-)=2×$\frac{0.55mol/L}{800min}$=0.001375mol•L-1•min-1,故答案为:0.001375mol•L-1•min-1;
②平衡常数仅随温度变化,不随溶液酸碱性,离子浓度变化,随着pH 变大,此反应的平衡常数不变,故答案为:不变;
③a.图象分析可知温度升高,消耗的FeO42-浓度增大,平衡正向进行,则说明温度升高平衡向吸热反应方向即正向进行,故反应是吸热反应,△H>0,故a正确;
b.升高温度,消耗的FeO42-浓度增大,平衡正向进行,生成氢氧根增多,则该反应pH增大,故b错误;
c.温度越高,反应速率越块,故c错误;
d.加入盐酸,消耗氢氧根离子,平衡正向移动,则FeO42-的浓度减小,故d正确;
故选:ad;
④a、由图象分析,不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故a错误;
b、由图象分析,向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大随后又减小,故b错误;
c、由图象分析,pH=6的这种溶液中,铁元素的存在形态有HFeO4-和FeO42-,加KOH溶液,只有HFeO4-能反应,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故c正确;
故答案为:c;
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,还原产物还能形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物.
点评 本题考查学生阅读题目获取信息的能力、氧化还原反应、反应速率的计算、平衡常数的判断、平衡移动原理等知识点,注意对图象的分析是解题的关键,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.

 阅读快车系列答案
阅读快车系列答案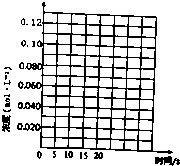 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0.容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(3)t分钟后容器III达到平衡,t>20s(填“>”“<”或“=”).判断的理由是甲醇的起始浓度相同,但容器I的温度大于容器III的温度.
请在图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
| A. | 淀粉、纤维素、蔗糖和麦芽糖水解的最终产物都是葡萄糖 | |
| B. | 可以用Na2CO3溶液或者NaOH溶液除去乙酸乙酯中的乙酸和乙醇 | |
| C. | 天然油脂是混合物,主要成分是饱和和不饱和的高级脂肪酸 | |
| D. | 蛋白质溶液中加入Na2SO4可使其析出,再加水蛋白质又会重新溶解 |
Na2O2(s)+CO2(g)═Na2CO3(s)+21O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:


