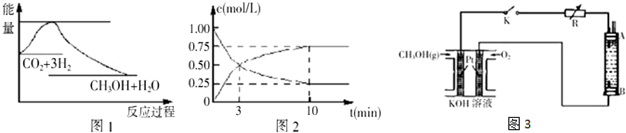
题目内容
19.已知KI溶液与Pb(NO3)2溶液混合后可形成沉淀PbI2,此沉淀的Ksp=7.0×10-9.现将等体积的KI溶液与Pb(NO3)2溶液混合,若原KI溶液的浓度为1×10-2mo1/L,则生成沉淀所需原Pb(NO3)2溶液的最小浓度为5.6×10-4 mol/L.分析 根据Qc≥Ksp分析求解,KI可与Pb(NO3)2反应生成PbI2,将等体积的KI溶液与Pb(NO3)2溶液混合,若KI的浓度为1×10-2mo1/L,则混合后c(I-)═5×10-3mol/L,根据Ksp=c[Pb(NO3)2]•c2(I-)计算即可.
解答 解:根据题意,KI可与Pb(NO3)2反应,沉淀是PbI2,若原KI溶液的浓度为1×10-2mo1/L,等体积混合后,c(I-)═5×10-3mol/L,根据Ksp=c[Pb(NO3)2]•c2(I-),则生成沉淀时,混合溶液中的Pb(NO3)2溶液的最小浓度c[Pb(NO3)2]=$\frac{{K}_{sp}}{{c}^{2}({I}^{-})}$=$\frac{7.0×1{0}^{-9}}{(5×1{0}^{-3})^{2}}$=2.8×10-4(mol/L),混合前,即原Pb(NO3)2溶液的最小浓度为2×2.8×10-4mol/L=5.6×10-4mol/L.
故答案为:5.6×10-4mol/L.
点评 本题考查溶度积的计算,根据Qc≥Ksp分析求解是解答关键,题目难度不大.

练习册系列答案
相关题目
12.在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应.
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol/(L•s).
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol/(L•s).
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
14.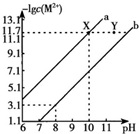 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )| A. | b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 | |
| B. | 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中C(Fe2+):C(Cu2+)=1:104.6 | |
| C. | 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 | |
| D. | 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
4.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,该反应为放热反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)?CO2(g)+H2(g),得到如下三组数据:
①实验A中以υ(H2) 表示的反应速率为0.16mol•L-1•min-1.
②通过计算可知,CO的转化率实验A大于 实验B(填“大于”、“等于”或“小于”),该反应的正反应为放(填“吸”或“放”)热反应.
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是b=2a(用含a、b的数学式表示).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,该反应为放热反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数③(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
②通过计算可知,CO的转化率实验A大于 实验B(填“大于”、“等于”或“小于”),该反应的正反应为放(填“吸”或“放”)热反应.
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是b=2a(用含a、b的数学式表示).
11.t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)?2Z(g),各组分在不同时刻的浓度如下表:
下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末浓度/(mol•L-1) | 0.08 | a | b |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | 2min时Y的物质的量为0.14 | |
| C. | 增大平衡后的体系压强,v(正)增大,v(逆)减小 | |
| D. | 2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol•L-1•min-1 |
9.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |