题目内容
3. 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0.容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(2)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(3)t分钟后容器III达到平衡,t>20s(填“>”“<”或“=”).判断的理由是甲醇的起始浓度相同,但容器I的温度大于容器III的温度.
请在图中分别画出容器I和容器III中CH3OH(g)浓度变化的曲线示意图.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
分析 (1)由I和Ⅲ可知,温度越高,生成CH3OCH3(g)越少,则升高温度平衡逆向移动;结合v=$\frac{△c}{△t}$计算速率,
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量:0.2 0 0
转化量:0.16 0.08 0.08
平衡量:0.04 0.08 0.08
平衡时浓度分别为0.02mol/L、0.04mol/L、0.04mol/L,结合K为生成物浓度幂之积与反应物浓度幂之积的比计算;
(2)容器Ⅱ达平衡时,压强是容器Ⅰ的两倍,CH3OH的体积分数和容器Ⅰ中的相同,则互为等效平衡,又该反应为气体体积不变的反应,所以只要反应物成比例即等效,等效平衡各物质的体积分数相同;
(3)温度低,反应速率慢,平衡正向移动,生成物增加;
(4)比较Qc与K,判断反应进行的方向.
解答 解:(1)温度降低,平衡向着放热方向移动,从图表可得,起始投入量相同时,Ⅲ比Ⅰ的温度低,平衡时二甲醚的物质的量大,说明正方向为放热方向,该反应为放热反应;容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为$\frac{\frac{2×0.08}{2L}}{20s}$=0.004mol/(L•s),
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量:0.2 0 0
转化量:0.16 0.08 0.08
平衡量:0.04 0.08 0.08
平衡时浓度分别为0.02mol/L、0.04mol/L、0.04mol/L,
390℃时该反应的平衡常数K1=$\frac{0.04×0.04}{0.0{2}^{2}}$=4,
故答案为:<;投料量相同时,温度高的容器,平衡时二甲醚的物质的量大,说明反应为放热反应,△H小于0;0.004;K1=4;
(2)容器Ⅱ达平衡时,CH3OH的体积分数和容器Ⅰ中的相同,则互为等效平衡,又该反应为气体体积不变的反应,所以只要反应物成比例即等效,又压强容器Ⅱ达平衡时是容器Ⅰ的两倍,所以开始反应物也应该是容器Ⅰ的两倍,则CH3OH起始的物质的量为0.40mol;等效平衡各物质的体积分数相同,所以平衡时CH3OH(g)的体积分数与容器Ⅰ相同,根据(1)的三段式,则容器Ⅰ平衡时CH3OH(g)的体积分数为$\frac{0.04}{0.08+0.08+0.04}$×100%=20%,所以容器Ⅱ平衡时CH3OH(g)的体积分数也为20%.
故答案为:0.40mol;20%;
(3)温度低,反应速率慢,平衡正向移动,生成物增加,甲醇的起始浓度相同,但容器I的温度大于容器III的温度,温度越高,速度越快,则t>20s;作图为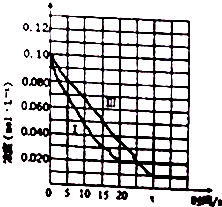 ,故答案为:>;甲醇的起始浓度相同,但容器I的温度大于容器III的温度;
,故答案为:>;甲醇的起始浓度相同,但容器I的温度大于容器III的温度; ;
;
(4)c(CH3OH)=$\frac{0.9mol}{3L}$=0.3mol/L,c(CH3OCH3 )=$\frac{0.6mol}{3L}$=0.2mol/L,c(H2O)=$\frac{0.3mol}{3L}$=0.1mol/L,Qc=$\frac{0.2×0.1}{0.{3}^{2}}$=$\frac{2}{9}$,因为390℃时该反应的平衡常数K1=4,则Qc=$\frac{2}{9}$<K=4,所以平衡向正反应方向移动,v正>v逆,
故答案为:>.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡移动、K的计算等为解答的关键,侧重分析与计算能力的考查,注意等效平衡的应用,题目难度不大.

 智慧小复习系列答案
智慧小复习系列答案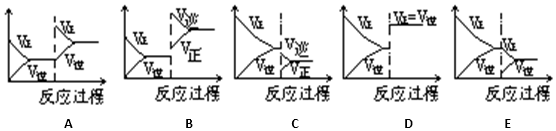
| 达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
| (1)使用催化剂 | ||
| (2)升温 | ||
| (3)降压 | ||
| (4)增加A的量 | ||
| (5)减少C的量 |
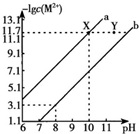 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )| A. | b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 | |
| B. | 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中C(Fe2+):C(Cu2+)=1:104.6 | |
| C. | 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 | |
| D. | 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末浓度/(mol•L-1) | 0.08 | a | b |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | 2min时Y的物质的量为0.14 | |
| C. | 增大平衡后的体系压强,v(正)增大,v(逆)减小 | |
| D. | 2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol•L-1•min-1 |
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:aA (g)+bB (g)?2C(g)
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO.则该电池的负极材料是锌;
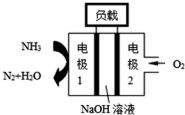
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图,该燃料电池工作时,电池的总反应为4NH3+3O2=2N2+6H2O;负极的电极反应为2NH3-6e-+6OH-═N2+6H2O.
| A. | 0.045 mol/L | B. | 1 mol/L | C. | 0.5 mol/L | D. | 2.24mol/L |
| 选 项 | 操 作 | 现 象 | 结 论 |
| A | 向无水乙醇中滴入酸性KMnO4溶液,充分振荡 | 紫红色褪去 | 乙醇有氧化性 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |