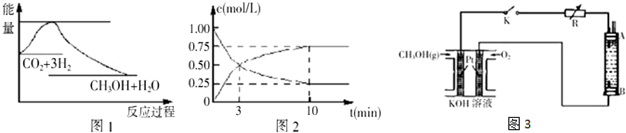
题目内容
1.按要求用物质序号填空,下列物质中:①盐酸 ②蒸馏水 ③熔化的氯化钠 ④液态氯化氢⑤铜 ⑥液氨 ⑦SO3⑧冰醋酸 ⑨固态硫酸钡(1)导电但不属于强电解质的是①⑤
(2)属于强电解质但不导电的是④⑨
(3)属于弱电解质的是②⑧
(4)属于非电解质的是⑥⑦.
分析 能导电的物质含有自由电子或自由离子,在水溶液里或熔融状态下能导电的化合物是电解质,能完全电离的电解质是强电解质,部分电离的电解质是弱电解质,据此分析解答.
解答 解:①盐酸是混合物,所以不是电解质,但都含自由离子所以能导电;
②蒸馏水部分电离,属于弱电解质;
③熔化氯化钠是强电解质且含有自由移动的离子所以能导电;
④液态氯化氢是强电解质,但没有自由移动的离子,所以不导电;
⑤铜是单质所以不是电解质,但能导电;
⑥液氨是非电解质,不能导电;
⑦三氧化硫是非电解质,不能导电;
⑧冰醋酸是弱电解质,没有自由离子所以不导电;
⑨固态硫酸钡是强电解质,但没有自由移动的离子,所以不导电;
(1)导电但不属于强电解质的是①⑤;
(2)属于强电解质但不导电的是④⑨;
(3)属于弱电解质的是②⑧;
(4)属于非电解质的是⑥⑦;
故答案为:(1)①⑤(2)④⑨(3)②⑧(4)⑥⑦.
点评 本题考查了电解质与非电解质的定义以及物质的导电性的判断,侧重考查学生的辨别能力,根据电离的程度来判断强弱电解质是解答的关键,要注意的是:电解质不一定导电,如BaSO4固体;导电的不一定是电解质,如铜,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.在温度、容积相同的 3 个密闭容器中,按不同方式 投入反应物,保持恒温、恒容,测 得反应达到平衡时的有关数据如表(已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1)
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | α1+α3<1 | B. | a+b>92.4 | C. | 2p2<p3 | D. | 2c1>c3 |
12.在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$.已知:K300℃>K350℃,则该反应是放热反应.
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol/(L•s).
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol/(L•s).
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
9.常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )

| A. | 在任何溶液中,若有CaSO4沉淀析出,则c(Ca2+)与c(SO42-)一定相等 | |
| B. | d点溶液通过蒸发可以变到c点 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
16.一定条件下反应A(g)+B(g)?C(g)△H<0达到平衡后,据下列图象判断:
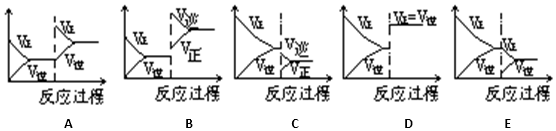

| 达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
| (1)使用催化剂 | ||
| (2)升温 | ||
| (3)降压 | ||
| (4)增加A的量 | ||
| (5)减少C的量 |
3.在25℃时,Ksp(FeS)=6.3×10-18 mol2•L-2 ,Ksp(CuS)=1.3×10-36 mol2•L-2,Ksp(ZnS)=1.3×10-24 mol2•L-2.下列有关说法不正确的是( )
| A. | 在25℃的蒸馏水中,FeS的溶解度最大 | |
| B. | 25℃时,CuS的饱和溶液中Cu2+的浓度约为1.14×10-18 mol•L-1 | |
| C. | 可用FeS固体作沉淀剂除去废水中的Cu2+ | |
| D. | 向物质的量浓度相同的FeCl2、ZnCl2混合液中加入少量Na2S,只有FeS沉淀生成 |