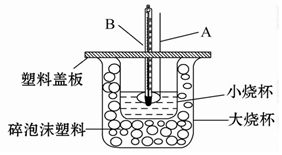
题目内容
18.将11.7g NaCl固体溶于水配成1L 溶液,所得溶液的物质的量浓度是0.2mol/L.分析 结合c=$\frac{n}{V}$、n=$\frac{m}{M}$计算.
解答 解:n(NaCl)=$\frac{11.7g}{58.5g/mol}$=0.2mol,溶液体积为1L,则所得溶液的物质的量浓度是$\frac{0.2mol}{1L}$=0.2mol/L,
故答案为:0.2mol/L.
点评 本题考查物质的量浓度的计算,为高频考点,把握质量、物质的量、体积的关系为解答的关键,侧重分析与计算能力的考查,注意溶液配制的方法,题目难度不大.

练习册系列答案
相关题目
9.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
13.下列实验“操作”、“现象”与“结论”对应关系正确的是( )
| 选 项 | 操 作 | 现 象 | 结 论 |
| A | 向无水乙醇中滴入酸性KMnO4溶液,充分振荡 | 紫红色褪去 | 乙醇有氧化性 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
3.常温下,下列溶液中酸性最强的是( )
| A. | PH=4 | B. | C(H+)=1×10-3 mol•L-1 | ||
| C. | C(OH-)=1×10-12 | D. | C(H+)/C(OH-)=1012 |
8.某无色溶液X中,可能含有Na+、Cu2+、Mg2+、Al3+、SiO32-、AlO2-、CO32-、Cl-中的一种或几种.现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列说法中不正确的是( )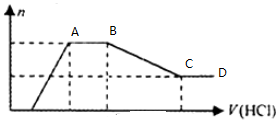

| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
 .
.