题目内容
17.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为: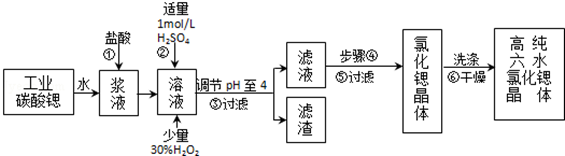
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
分析 以SrCO3为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O,以此来解答,
(1)依据影响化学反应速率的因素选择,换做硫酸会大量生成硫酸锶的沉淀;
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,同时生成水;
(3)调节pH除去Fe3+等,要不能引入杂质;
(4)由于前面加入了稀硫酸故有硫酸钡生成,水解可生成氢氧化铁沉淀,所以沉淀有两种即BaSO4、Fe(OH)3;
(5)工业上完成操作③分离溶液和滤渣,类似于过滤;
(6)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水;
(7)工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg),工业流程中锶的利用率为90%,依据锶元素守恒计算;
解答 解:以SrCO3为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O,
(1)增大反应速率,则增大浓度,加热,或者搅拌,增大接触面积,不能操作①中盐酸改用硫酸,否则会大量生成硫酸锶的沉淀,减少产物生成,
故答案为:加热或充分搅拌或适当增加盐酸浓度等;不能,否则会大量生成硫酸锶的沉淀,减少产物生成;
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,同时生成水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调节pH除去Fe3+等,要不能引入杂质,最好选用氢氧化锶粉末或氧化锶粉末,
故答案为:B;
(4)由于前面加入了稀硫酸故有硫酸钡生成,水解可生成氢氧化铁沉淀,所以沉淀有两种即BaSO4、Fe(OH)3,
故答案为:Fe(OH)3、BaSO4;
(5)工业上完成操作③分离溶液和滤渣,类似于过滤,所以选择B离心机,
故答案为:B;
(6)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是50~60℃,
故答案为:B.
(7)工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg),工业流程中锶的利用率为90%,
则碳酸锶的纯度=$\frac{\frac{a×1000g}{267g/mol×90%}×148g/mol}{W×1000g}$×100%=$\frac{1480a}{267W×9}$×100%,
故答案为:$\frac{1480a}{267W×9}$×100%.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中发生的化学反应及物质分离方法为解答的关键,涉及反应速率、氧化还原反应、滴定原理等,注意信息与所学知识的综合应用,综合性较强,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案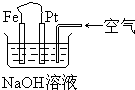
| A. | 这是电解NaOH溶液的装置 | |
| B. | Pt为正极,其电极反应为:O2+2H2O+4eˉ═4OHˉ | |
| C. | Fe为阳极,其电极反应为:Fe-2eˉ+2OHˉ═2Fe(OH)2 | |
| D. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 |
| A. | 向苯酚中加浓溴水观察沉淀 | |
| B. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| C. | 苯与浓溴水反应制取溴苯 | |
| D. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与3mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 该有机物与NaHCO3溶液反应 |
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑ ①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑ ③
下列说法正确的是( )
| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、②的反应速率相等 |


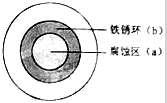 铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题
铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题 0 g铁的物质的量
0 g铁的物质的量