题目内容
9.有关如图所示化合物的说法不正确的是 ( )
| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与3mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 该有机物与NaHCO3溶液反应 |
分析 该分子中含有酯基、苯环、酚羟基、醚键、碳碳双键,具有酯、苯、酚、醚和烯烃性质,能发生水解反应、取代反应、氧化反应、加成反应、加聚反应等,以此解答该题.
解答 解:A.该物质中含有碳碳双键,具有烯烃性质,能和溴发生加成反应,甲基能和溴在一定条件下发生取代反应,故A正确;
B.能和NaOH反应的有酚羟基、酯基水解生成的羧基,所以1 mol该化合物最多可以与3 molNaOH反应,故B正确;
C.含有碳碳双键,可与氢气发生加成反应,也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故C正确;
D.酚羟基酸性比碳酸弱,与碳酸氢钠不反应,故D错误.
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查酯、酚、烯烃性质,注意酚羟基能和碳酸钠反应但不能和碳酸氢钠反应,易错选项是D.

练习册系列答案
相关题目
17.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
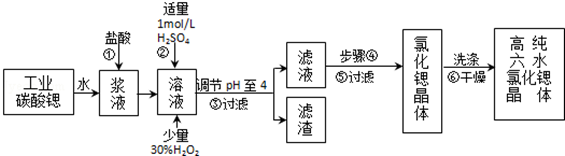
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有加热或充分搅拌或适当增加盐酸浓度等(写一种).操作①中盐酸能否改用硫酸,其理由是:不能,否则会大量生成硫酸锶的沉淀,减少产物生成
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
4.在滴加合成洗涤剂的H2O2的水溶液中,加入下列物质时,能使实验现象更明显的是( )
| A. | 稀H2SO4 | B. | NaOH溶液 | C. | MnO2 | D. | CaO |
14.已知: 的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
 的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )| A. |  的名称为3-苯基-2-丙醇 的名称为3-苯基-2-丙醇 | |
| B. | 4-苯基-2-丁醇与 互为同系物 互为同系物 | |
| C. | 4-苯基-2-丁醇分子中的所有碳原子一定共平面 | |
| D. | 4-苯基-2-丁醇的核磁共振氢谱共有8个峰 |
1.下列有关物质结构的说法正确的是( )
| A. | 1molH2O含有2mol氧元素 | |
| B. | 1.8gNH4+中含有的质子数为NA | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和HCl分子中所有原子的最外层都达到8电子稳定结构 |
18.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
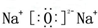 .F的原子结构示意图为
.F的原子结构示意图为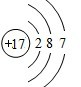 .
.