题目内容
12.能正确表示下列反应的离子方程式是( )| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
分析 A.离子方程式两边负电荷不相等,违反了电荷守恒;
B.铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水;
C.碳酸氢根离子不能拆开;
D.氨水为弱碱,反应生成氢氧化铝沉淀.
解答 解:A.Cl2通入NaOH溶液,反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故A错误;
B.Cu溶于稀HNO3,反应生成硝酸铜、NO气体和水,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故B正确;
C.NaHCO3溶液中加入稀HCl,碳酸氢根离子不能拆开,正确的离子方程式为:HCO3-+H+═CO2↑+H2O,故C错误;
D.AlCl3溶液中加入过量稀氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.在pH=13的无色溶液中,可以大量共存的一组离子是( )
| A. | NH4+、NO3-、K+、SO42- | B. | CO32-、NO3-、HCO3-、Na+ | ||
| C. | Na+、ClO-、AlO2-、NO3- | D. | Cu2+、K+、Na+、SO42- |
7.实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗.正确的操作顺序是( )
| A. | ①②③④⑤ | B. | ②④②③① | C. | ④②③① | D. | ②④①③ |
17.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
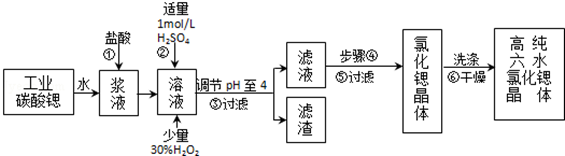
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有加热或充分搅拌或适当增加盐酸浓度等(写一种).操作①中盐酸能否改用硫酸,其理由是:不能,否则会大量生成硫酸锶的沉淀,减少产物生成
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
4.在滴加合成洗涤剂的H2O2的水溶液中,加入下列物质时,能使实验现象更明显的是( )
| A. | 稀H2SO4 | B. | NaOH溶液 | C. | MnO2 | D. | CaO |
1.下列有关物质结构的说法正确的是( )
| A. | 1molH2O含有2mol氧元素 | |
| B. | 1.8gNH4+中含有的质子数为NA | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和HCl分子中所有原子的最外层都达到8电子稳定结构 |

 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同



 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯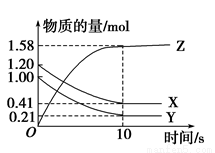
 Z(g)
Z(g)